«Практичні аспекти формування ключових компетентностей через розв΄язування задач з хімії ».
Методичний посібник
«Практичні аспекти формування ключових компетентностей через розв΄язування задач з хімії »
Передмова
Компетентність – загальна здатність людини раціонально діяти у різноманітних ситуаціях, ефективно розв’язувати актуальні проблеми у різних сферах життєдіяльності. Компетентність є кінцевим результатом навчання, мета якого полягає у формуванні й розвитку особистості учня, розкритті його здібностей і талантів. Основні елементи компетентностей це: знання, діяльність, мотивація, цінності.
Практично усі уроки хімії сприяють формуванню в учнів соціальної, здоров’язберігаючої, математичної, інформаційно – цифрової, екологічної та читацької компетентностей.
Ефективність засвоєння знань залежить від мотивації навчально –пізнавальної діяльності, самостійності, творчої ініціативи. Мотив навчання –це внутрішній чинник кожної дитини. Пізнавальні мотиви лежать в основі самого процесу навчання. Вони зумовлені змістом навчального матеріалу, діяльністю учнів на уроці, стосунками між учителем та учнями; спонукають учня вчитися, впливають на його ставлення до навчальної діяльності й позначаються на якості набутих знань. Арабський письменник і філософ Сааді зазначав, «Учень, який вчиться без бажання–це птах без крил». Систематичне розв’язання розрахункових задач з хімії сприяє свідомому засвоєнню хімічних знань, формуванню логічного мислення, розвитку розумової діяльності, навчає практичному використанню набутих знань. Введення задач у навчальний процес дає змогу реалізувати наступні принципи навчання:
-забезпечення самостійності й активності учнів;
-досягнення єдності знань і вмінь;
-встановлення зв’язку навчання з життям.
Розрахункові задачі можна використовувати на усіх етапах навчального
процесу: вивченні нового матеріалу, перевірці та контролю знань.
ЗМІСТ
Передмова…………………………………………………………….3
1. Задачі пізнавального характеру…………………………………..5
2. Задачі екологічного змісту………………………………………..21
3. Задачі біологічного характеру……………………………………29
4. Задачі на формування читацької компетентності……………….39
Література…………………………………………………………….57
1. Задачі пізнавального характеру
1.1. До кінця XIX століття до «спиртів» відносили цілий ряд летких рідин – неорганічних сполук, які в сучасному розумінні органічної хімії, до спиртів не мають відношення. Це концентровані кислоти – «соляний» або «солений спирт», «селітрянний спирт» або «міцна горілка» їх суміші «царська горілка», «купоросний» або «сульфатний спирт».
Написати формули відповідних кислот, назвати за сучасною українською номенклатурою, описати їх застосування.
1.2. К.Е.Ціолковський як джерело енергії для руху ракет у космосі використав горіння водню у кисні.
А) Написати рівняння реакції сполучення.
Б) В якому об’ємному та масовому співвідношенні слід подавати водень і кикисень,щоб не відбулося надмірного витрачання ні одного, ні другого газу?
1.3. У 1903 році в американському штаті Канзас з нафтової свердловини раптово забив фонтан газу. На великий подив нафтовиків, газ виявився негорючим. Нова зустріч з ним припала на роки Першої світової війни. У німецький дирижабль, що скидає бомби на Лондон, потрапив запальний снаряд, але дирижабль не спалахнув. Повільно стікаючи газом, він відлетів геть. Секретні служби Англії переполошилися: до цього німецькі дирижаблі вибухали від попадання снарядів, так як були наповнені воднем. Експерти-хіміки згадали, що задовго до війни німецькі пароплави чомусь везли, як баласт монацитовий пісок (торієвий пісок) з Індії та Бразилії. Цим газом був гелій.
Що є спільним у електронній будові частинок Гідрогену, Карбону, Гелію з такими ступенями окиснення: ![]() , С+4, Не? Відповідь обґрунтуйте.
, С+4, Не? Відповідь обґрунтуйте.
1.4. В процесі дослідження мистецтвознавці вияснили, що у старовину багато картин писали масляними фарбами, до складу яких входили деякі сполуки Плюмбуму, наприклад, основний карбонат Pb3(OH)2(CO3)2 – свинцеві білила. Під дією сірководню, що є в повітрі, свинцеві білила перетворювалися на чорний плюмбум (ІІ) сульфід, тому картини поступово тьмяніли:
Pb3(OH)2(CO3)2 + H2S → PbS + H2O + CO2
Для реставрації старих картин їх обробляють 3% розчином гідроген пероксиду, у результаті чого потемнілі фарби відновлюють своє забарвлення. Відбувається реакція PbS + H2O2 → PbSO4 + H2O.
Зараз через свою отруйність свинцеві білила в масляних фарбах майже не застосовують.
А) Використовуючи метод електронного балансу, перетворіть схеми даних реакції на хімічні рівняння.
Б) Скільки таблеток сухого гідроген пероксиду потрібно для приготування 200 г 3% розчину, якщо маса однієї таблетки становить приблизно 1 г?
1.5. Знаменитий англійський хімік і фізик Вільям Рамзай в кінці 19 століття вперше виділив зразок земного гелію (He), в якому містилося 5,34 x 1020 атомів цієї речовини.
Обчисліть, якій кількості речовини відповідає це число атомів.
1.6. Процеси горіння можуть відбуватися без участі кисню і він сам може бути продуктом горіння. У середовищі фтору спалахує і горить «гірський льон» —азбест, а вода горить блідо-фіолетовим полум’ям:
А) F2 + H2O → HF + O2;
Б) F2 + H2O → HF + O3;
В) F2 + H2O → HF + H2O2;
Г) F2 + H2O → HF + OF2.
Використовуючи метод електронного балансу, перетворіть схеми запропонованих реакцій на хімічні рівняння та укажіть коефіцієнт перед формулою окисника.
1.7. Хлор взаємодіє з усіма неметалами, крім вуглецю, кисню та азоту. Реакція взаємодії хлору з воднем перебігає своєрідно: у темряві хлор з воднем не реагує, однак при сильному освітленні реакція відбувається з вибухом. Отже, суміш водню та хлору, як і суміш водню з киснем, є «гримучою». Уперше цю реакцію досліджував російський хімік М.М. Семенов і встановив, що це ланцюгова реакція. За розробку теорії ланцюгових реакцій учений у 1956 році одержав Нобелівську премію.
А) Змішали 1 л хлору та 2 л водню (н. у.). Визначте, яку масу хлороводню можна отримати з такої суміші.
Б) Визначте об΄єми (н. у.) хлору та водню, необхідних для одержання хлоридної кислоти масою 200 г з масовою часткою НСІ 18,25%.
1.8. Солоний смак морській воді надають розчинені мінеральні речовини – головним чином, сполуки натрію і хлору. Завдяки тому, що вода в морях і океанах постійно перемішується хвилями і течіями, її склад практично однаковий. Тобто, з якою б глибини і в якому б місці ми не взяли воду, склад її буде ідентичним, хоча абсолютна кількість солей і може бути різною. Обчисліть масу прісної води, яку необхідно додати до 7 кг морської води, щоб зменшити в ній уміст солей у 2,5 рази.
1.9. Йод відкрив в 1811 році французький хімік Б. Куртуа. Винуватцем відкриття був улюблений кіт Куртуа: він лежав на плечі хіміка, коли той працював в лабораторії. Бажаючи розважитися, кіт стрибнув на стіл і зіштовхнув на підлогу судини, які стояли поруч. В одній з них перебував спиртовий розчин золи морських водоростей, а в іншій — сульфатна кислота. Рідини змішалися, і в повітря почав підніматися фіолетовий пар, осідаючи на предметах дрібними чорно-фіолетовими кристаллами,що було не чим іншим як йодом.
Використовуючи метод електронного балансу, перетворіть схему реакції на хімічне рівняння та укажіть коефіцієнт перед формулою відновника:
KMnO4 + HI = KI + MnI2 + I2 + H2O
1.10. Французький хімік, аптекар і лікар Нікола Лемері (1645-1715) свого часу спостерігав щось схоже на вулкан, коли, змішавши в залізній чашці 2 г залізної тирси і 2 г порошкоподібної сірки, доторкнувшись до неї розпеченою скляною паличкою. Через деякий час з приготовленої суміші почали вилітати частинки чорного кольору, і сама вона, сильно збільшившись в обсязі, так розігрілася, що почала світитися. Обчисліть масу ферум (ІІ) сульфіду, що утворився в результаті реакції.
1.11.Сухозлітка – це кристалічний станум(ІІ) сульфід SnS2золотистого кольору. Міститься в складі фарб для гіпсових, дерев’яних та інших виробів. Визначити масу сірки, що містить 10% домішок, необхідної для добування 54,9кг сухозлітки із простих речовин.1.12.Натрій тіосульфат у часи першої світової війни називали «антихлором», яким солдати і офіцери російської армії користувалися для захисту від отруйної і згубної дії хлору. Захисну маску, виготовлену із кількох шарів марлі змочували розчином соди і тіосульфату. Сода нейтралізувала кислоти — HCl і H2SO4, які утворювалися в результаті реакцій:
Na2S2O3 + Cl2 + H2O → Na2SO4 + S↓+ HCl
Na2S2O3 + Cl2 + H2O → Na2SO4 + H2SO4 + HCl
А)Використовуючи метод електронного балансу, перетворіть схеми запропонованих реакцій на хімічні рівняння та укажіть суму коефіцієнтів у лівій частині рівняння.
Б)Написати рівняння нейтралізації;
1.13. Бінарна сполука Гідрогену і Нітрогену (масова частка якого 97,67%) належить до кислот. Це легкокипляча рідина (t◦кип= +37◦C), що легко вибухає внаслідок нагрівання, і навіть від незначного струшування. При цьому утворюється синє полум’я.
Виведіть молекулярну формулу сполуки. Укажіть суму індексів в істинній формулі цієї сполуки.
1.14. Історії виникнення хімічних термінів завжди цікаві. Термін «амоніак» пов'язаний з ім’ям єгипетського бога Амона. Храм цього бога у Стародавньому Єгипті опалювали верблюдячим гноєм, серед продуктів горіння були сполуки NH3iHCl. Bнаслідок цього стіни та стеля храму вкрилися сажею, на фоні якої виблискували білі голчасті кристали, які отримали назву «сіль Аммона».
Який склад цієї солі? Як називають цю сполуку у побуті?
1.15. У XVII ст. Й. Глаубер запропонував метод добування летких кислот реакцією їх солей зокрема калійної селітри (KNO3), із концентрованою H2SO4. Завдяки цьому в хімічну практику було введено концентровану нітратну кислоту, досліджені її властивості. Метод Глаубера застосовувався до початку ХХ ст., а єдиною істотною модифікацією його була заміна калійної селітри на дешеву – натрієву селітру.
Обчисліть масу нітратної кислоти, яку можна добути з калій нітрату масою 20,2 г при дії на нього надлишком сульфатної кислоти, якщо вихід HNO3 98%.
1.16. В архіві Французької Академії наук знайдено фрагмент патентної заявки Ніколя Леблана, датованої 1790 р. Час не зберіг більшої частини тексту. Але, можливо, за фрагментом, який залишився, ви зможете розібратися і пояснити, про що йдеться в заявці.
“Кухонну сіль розкладають за методом Глаубера, тобто дією (1) кислоти. Для розкладу солі слід брати майже рівну за вагою кількість (1) кислоти. Щоб дістати кращий вихід хлоридної кислоти, слід перетворити її на нашатир. Для цього (2) поглинають розчином (3). Додають певну кількість іншого продукту першої реакції, солі (4), до половини за її вагою вапняку або крейди та до четвертини за її вагою порошкоподібного вугілля. Сумішшю заповнюють тигель, у якому залишають отвори. Незабаром утворюється значна кількість займистої речовини (5). Суміш поступово доводять до плавлення. Після цього можна переконатися, що суміш, яка перетворилася на сиру соду, може бути видалена з тигля (6)”.
А) Заповніть пропуски (1) – (6) в тексті назвами речовин.
Б) Наведіть рівняння всіх реакцій, вкажіть умови їх перебігу.
В) Які побічні продукти утворюються в такій схемі синтезу? Як їх можна використати?
Г) Як в наш час добувають цільовий продукт цієї схеми? Де його використовують?
1.17. Рецепт виготовлення чорного пороху, описаний у ХІІІ ст. в “Книзі вогню” Марка Грека, такий: “Взяти 1 фунт сірки, 2 фунти деревного вугілля, 6 фунтів калійної селітри, дрібно розтерти ці речовини на мармуровій дошці і змішати”.
А) Розрахуйте масові й молярні частки компонентів суміші.
Б) Напишіть можливе рівняння реакції горіння чорного пороху.
В) Вкажіть роль кожного компонента суміші у процесі горіння.
Г) Які побічні продукти можуть утворитися при горінні пороху?
1.18.Білий фосфор, що горить на повітрі, рекомендують гасити розчином мідного купоросу.
Використовуючи метод електронного балансу, перетворіть схему реакції на хімічне рівняння та укажіть коефіцієнт перед формулою відновника:P4 + CuSO4 + H2O → Cu + H3PO4 + H2SO4
1.19. Амоній карбонат і амоній гідроген карбонат уже при слабкому нагріванні повністю розкладаються з утворенням газів, що розпушують тісто. Тому вони використовуються як розпушувачі тіста на кондитерських фабриках.
Обчисліть об’єм (н.у.) амоніаку і вуглекислого газу, які утворюються при термічному розкладі NH4HCO3, якщо в тісто внесемо цю сіль масою 4,74г.
1.20. Перші відомості про негашене вапно трапляються у «Природній історії» Плінія, які сягають першого століття нашої ери. Вапно – найдавніший у світі в΄яжучий матеріал. Археологічні дослідження виявили, що вже будівельники Давнього Єгипту застосовували вапно як в΄яжучий матеріал.
Обчисліть масу кальцій оксиду, який утворюється під час термічного розкладу 200 кг вапняку, у якому масова частка некарбонатних домішок становить 10%.
1.21. У романі Г.Р. Хаггарда «Клеопатра» є один епізод: «…вона вийняла з вуха одну з тих величезних перлин … і … опустила перлину в оцет. Настало мовчання, вражені гості завмерли, спотерігали, як незрівнянна перлина повільно розчиняється в міцному оцті. От від неї не залишилося й сліду, і тоді Клеопатра підняла кубок, покрутила його, збовтуючи оцет, і випила весьдо останньої краплі». Основою перлини є кальцій карбонат.
Обчисліть об΄єм вуглекислого газу (н.у.), який утворився, якщо перлина була вагою 5 г.
1.22. Гірський кришталь – це кристалічний безкольоровий кварц (SiO2). У Стародавній Греції вважали, що це закам΄яніла кришталева вода, яка зовсім утратила тепло. Завдяки своїй прозорості, гірський кришталь здавна використовувався для виробництва лінз. Олімпійський вогонь у Древній Греції запалювали також за допомогою кришталевих лінз.
Яка маса атомів Силіцію міститься в кристалі гірського кришталю масою 200 г ?
1.23. Плавикову кислоту застосовують для нанесення на скло малюнків, оскільки вона взаємодіє з силіцій (ІV) оксидом скла, тобто «плавить» його (звідси її назва):
SiO2 + 4HF = SiF4 + 2H2O
Для цього скло вкривають тонким шаром парафіну, наносять малюнок а потім виріб занурюють у розчин плавикової кислоти. Під дією кислоти на склі залишається малюнок. Таким способом видатний литовський художник М.Чюрльоніс створив майже 30 художніх творів, що зберігаються в музеї його імені в Каунасі.
Яку масу піску з масовою часткою домішок 10% необхідно для реакції з 400 г 20% розчину плавикової кислоти.
1.24. Якось Деві спробував кинути потассіум (так він назвав калій) у воду. Здавалося б, метал, кинутий у воду, мав негайно впасти на дно й спокійно лежати там. Так, принаймні, поводилися всі старі метали, відомі Деві. Але з потассіумом відбулося інше. Тонути він не став. З гучним шипінням цей метал забігав по поверхні води. Потім пролунав оглушливий вибух, і над потассіумом спалахнуло лілове полум΄я. Так він і носився по воді з вогнем і тріском, усе зменшуючись, поки не перетворився на їдкий луг, який відразу зник у розчині.
Визначте масу лугу, що утвориться внаслідок взаємодії 15,6 г калію з водою масою 7,8 г.
1.25. Смарагд – старовинна назва мінералу – берилій алюмосилікату складу Be3Al2(SiO3)6, якийгеологи називають берилом. Це коштовний камінь зеленого кольору. У смарагдову чашу за біблейською легендою, зібрали кров Христа. Римський імператор Нерон через смарагдовий монокль спостерігав палаючий Рим. Йогог вважають оберегом матерів і мореплавців. Найпрекрасніші камені добувають у провінції Мюзо у Китаї.
Визначте масову частку Берилію у смарагді.
1.26.Сапфіри (Al2O3) синього кольору здавна були «корорлівськими каменями» - символами мудрості, влади, перемоги. Сапфіри зустрічалися рідше діамантів, що давало сильним світу цього ще одну причину віддавати перевагу саме цьому коштовномукаменю. Перші родовища сапфірів розташовувалися на території сучасної Шрі-Ланки, і сьогодні це місце все ще дає сині сапфіри. В даний час найбільшими постачальниками сапфірів є Австралія і Африка, а Камбоджа і Бірма теж відновили видобуток високоякісних сапфірів. Це різновид корунду з масовою часткою Алюмінію 52,9 % та домішками Титану й Феруму.
Обчисліть масу кристалу сапфіру, в якому міститься 5,4 г атомів Алюмінію.
1.27. Веллер одержав декілька грамів нового металу. Слідом за ним інший учений з допомогою натрію одержує кілограм, а пізніше тонни нового металу. Але метал коштував так само дорого, як срібло. Французи виготовили з нього кісари охоронцям Наполеона й іграшки спадкоємцю його Величності.
Визначте цей метал, якщо він є тривалентний, масова частка в його оксиді становить 53%. Складіть формулу оксиду та вкажіть його назву.
1.28. Чистий алюміній не розчиняється у воді, його захищає оксидна плівка. Учені Казахстану одержали сплав алюмінію з добавками галію, індію й олова. Ці добавки перешкоджають утворенню оксидної плівки, й алюміній активно реагує з водою. Виділяється велика кількість водню. Швидкість можна регулювати, а отже, змінювати в потрібному напрямку надходження водню. Водень – екологічно чисте автомобільне пальне.
Який об΄єм водню (н.у.) виділиться під чяс реакції алюмінію масою 0,81г з водою?
1.29. На домовині китайського полководця Чжао Чжу, похованого в 316 р, розміщений металевий орнамент. Коли хіміки зробили аналіз сплаву, то з`ясували що він складається з 5% магнію, 10% міді й 85% алюмінію. Наука до тепер не може пояснити, як удалося давнім китайцям одержати такий сплав.
Визначте, скільки грамів кожного металу міститься у 20 г сплаву.
1.30. Грецькі слова «хайма» і «літос» - кривавий камінь, лежать в основі назви мінералу «гематиту», а російською мовою його називають «кровавик».
Масові частки Феруму і Оксигену відповідно становлять 70% і 30%. Визначити формулу гематиту.
1.31. Гематит (Fe2O3) – напівкоштовний камінь від чорного до червоного кольору, відомий ще в стародавньому Єгипті. Здавна гематит у срібній оправі вважався каменем наполегливих і цілеспрямованих людей. Будучи символом мудрості й хоробрості й надаючи сили й невразливість у бої, він служив амулетом для воїнів у вигляді фігурки божка. Камінь давав їм надію повернутися з війни живими й здоровими.
Масова частка Феруму в ньому становить 0,7. Обчисліть масу Феруму в камінчику гематиту масою 50 г.
1.32. За твердженням геохіміків металічне залізо у стопі з іншими металами становить ядро земної кулі. Свідченням цього є висока магнітність нашої планети, а також хімічний склад метеоритів. Природне залізо складається з чотирьох стабільних ізотопів:![]() (5,8%),
(5,8%), ![]() (91,7%),
(91,7%), ![]() (2,2%),
(2,2%), ![]() (0,3%).Правильним стосовно природних ізотопів Феруму є твердження:
(0,3%).Правильним стосовно природних ізотопів Феруму є твердження:
А) вони відрізняються кількістю електронів
Б) вони відрізняються кількістю нейтронів
В) вони відрізняються кількістю протонів
Г) вони відрізняються кількістю електронів і протонів.
1.33. У місячному грунті виявлені мінерали, що відомі на Землі,- феросиліт FeSiO3, альбіт NaAlSi3O8, форстеріт Mg2SiO4 , ільменіт FeTiO3 .У місячній речовині виявлені також мінерали, яких не знайдено на Землі. Наприклад, мінерал армолколіт (Fe,Mg)Ti2O5,який було названо на честь Нейла Армстронга, першої людини, що ступила на Місяць.
Виразіть склад мінералів, які виявлено на Місяці, через оксиди, що їх утворюють.
1.34. Автори «Енциклопедії домашнього господарства» наводять багато відомостей про використання хімікатів у побуті, проте їхні властивості описують без пояснень.
Як хімік пояснить такі факти,що містяться у даній енциклопедії?
А) «розчини солей Феруму (ІІ) треба зберігати у склянках, що заповнені повністю, до відказу»
Б)«мідний купорос не можна зберігати у залізному посуді».
1.35. Нікель проявляє отруйну дію на високоорганізованих тварин і людину. Англійські токсикологи помітили, що через 30 років після пуску нікелевого заводу робітники стали частіше вмирати від раку легенів та носа. Причина цього – запиленість повітря частинками нікелю. Природний нікель складається з пяти стійких ізотопів:![]() (67,8%),
(67,8%), ![]() (26,1%),
(26,1%), ![]() (1,2%),
(1,2%), ![]() (3,7%),
(3,7%), ![]() (1,2%).
(1,2%).
Обчисліть середню відносну атомну масу Ніколу.
1.36. Як відомо, срібло практично не окиснюється киснем, однак, як зазначав Пліній Старший, “ тьмяніє від цілющих вод і від солоних вітрів ”.
При тривалому зберіганні срібні предмети (посуд, прикраси тощо) втрачають блиск, покриваючись тонким шаром сполуки X. Існує багато способів повернення втраченого блиску. Ось деякі з них:
- виріб кип’ятять у содовому розчині в алюмінієвому посуді;
- виріб на декілька хвилин опускають в розчин роданіду калію або амонію;
- виріб обробляють водно-спиртовим розчином тіосечовини SC(NH2)2 в суміші з хлоридною або ортофосфотною кислотою з додаванням прального порошку.
А) Визначте сполуку Х. Наведіть рівняння реакції, внаслідок якої срібні предмети втрачають блиск.
Б) Наведіть рівняння згаданих у тексті реакцій, що дозволяють ”відновити красу” срібних виробів.
В) Де краще буде розчинятися сполука Х – у водному розчині HNO3з концентрацією 6 моль/л чи у розчині HCl такої ж самої концентрації?
Г) У давнину срібний посуд часто використовували для зберігання питної води. Це можна пояснити бактероцидними властивостями малих кількостей йонів Ag2+, які, в свою чергу, можна пояснити тим, що вони втручаються в життєдіяльність мікробів, блокуючи роботу ферментів. Чому йони деяких інших важких металів, наприклад Cu2+ і Hg2+, що діють на мікроби аналогічно, набагато токсичніші для людини, ніж йони Ag2+.
1.37. Вавилонський цар Бурна-буріаш дуже розгнівався, коли одержав у подарунок від єгипетського фараона Аменхотепа IV - чоловіка Нефертіті- неповноваге золото. От що ми читаємо в його листі: «Коли 20 мін золота поклали в піч, одержали тільки 5 мін чистого золота». Міна-це старовинна міра ваги, що дорівнює 489,6 г.
Визначте, скільки грамів чистого золота одержав вавилонський цар. Скільки відсотків чистого золота було в подарунку ?
1.38. Найдорожчий метал – каліфорній, хімічний елемент із протоннимчислом 98. До 1984 року вченівиготовили всього один граммкаліфорнію, ікоштуваввін один міліард доларів.
Записати формулу нукліду, визначити тип елемента, кількість енергетичних рівнів, кількість протонів, кількість нейтронів, загальну кількість електронів.
1.39.Історія досліджень етилену, починається у 17 столітті, коли німецький хімік, лікар і винахідник І.І.Бехер у 1666 році почав проводити досліди з сульфатною кислотою. В одному з дослідів він замість додавання до нагрітої концентрованої сульфатної кислоти ще однієї її порції підлив етанол, який знаходився поряд у склянці і отримав нове «повітря», як тоді називали гази. Всупереч детальним дослідженням, назви Бехер йому так і не дав.
А) Визначити об’єм етену (н.у.), який можна добути з 200мл (ρ = 0,8г/мл) етанолу.
Б) При нагріванні 15г 95%-го етанолу з концентрованою сульфатною кислотою утворилося 4л вуглеводню (н.у.). Знайти об’ємну частку виходу продукту.
1.40. Полімеризацію ізопрена вперше здійснив французький хімік Г.Бутард у 1879 році дією на ізопрен концентрованої хлоридної кислоти з утворенням каучукоподібної маси, яка за свідченням Бутарда, «…мала еластичність і інші якості природного каучука: не розчинялася і спирті, набухала в етері і сіркокарбоні та розчинялася в них так само, як і природний каучук». У цьому ж році У.Тільден виділив під час піролізу скіпідару ізопрен і перетворив його на еластичну масу.
Органічна речовина містить W(Ca) – 88,24% і W(H) – 11,76%. Визначте формулу вуглеводню. Напишіть рівняння реакції полімеризації визначеної речовини.
1.41. Уперше цей газ був виділений Едмундом Деві в 1836 році в результаті розкладу водою кальцій карбіду. Газ горить на повітрі яскравим кіптявим полум΄ям. Ще в 1895 році Ле Шательє виявив, що згоряючи в кисні, він дає дуже гаряче полум΄я (до 3000 С), тому його використовують для зварювання та різки тугоплавких металів.
Виведіть молекулярну формулу цього вуглеводню, при спалюванні 2,24 л якого утворюється 4, 48 л карбон (ІV) оксиду (н.у.), а густина сполуки дорівнює 1,1607 г/л.
1.42. Хлороетан застосовується як холодоагент, як розчинник жирів та ефірних олій, а також у виготовленні тетраетилплюмбуму
4 С2Н5СІ + 4NaPb → (С2Н5)4Pb + 3Pb + 4NaCl
Який протягом кількох десятиліть був незамінним антидетонатором рідкого палива. В останні роки його застосування скоротилося, оскільки були відкриті менш токсичні антидетонатори.
Визначити масу тетраетилплюмбуму, який можна добути з 71,67 кг хлороетену, що містить 10% домішок.
1.43. У 1812 – 1815 роках у Лондоні з΄явилося газове освітлення. Світильний газ , який одержували з жиру морських тварин, доставлявся в залізних балонах. Балони зберігались у підвалі будинку, з них газ по трубах розподілявсь по всьому приміщенні. Згодом було помічено одну особливість: з часом газ утрачав здатність давати під час горіння яскраве світло. Власники газового заводу в 1825 році звернулись за порадою до Фарадея, який виявив, що складові газу, які згоряють яскравим полум΄ям, збираються на дні балона у вигляді прозорого рідкого шару. Досліджуючи цю рідину, Фарадей відкрив новий вуглеводень, назву якому пізніше дав Лібіх.
Внаслідок спалювання 0,65 г цієї речовини добули 2,2 г карбон (ІV) оксиду, та 1,45 г води. Густина пари цієї речовини за воднем дорівнює 39. Знайдіть молекулярну формулу та назвіть сполуку.
1.44. n-цинол або 1-метил- 4- ізопропілбензен – безбарвна речовина з приємним запахом. Міститься в ефірних оліях рослин, зокрема в чебреці звичайному родини ясноткові.
Написати формулу органічної речовини, вказати клас вуглеводнів, загальну формулу гомологічного ряду.
1.45.Метанол легко займається і горить блакитним полум΄ям, з повітрям утворює вибухонебезпечні суміші. У 16 столітті метанол також одержували під назвами «мефіль», «камфін» та «мефіловий спирт».Його також використовували для освітлення будинків,виготовлення лаків і політур. Першим метанол синтезував М.Бертло у 1858 році за такою схемою:
CS2 → CH4 → CH3Cl→KOH CH3OH
Визначити масу метанолу, яку можна добути з 224л біля природного газу(н.у.), що містить 90% метану. Практичний вихід продукту становить 90% від теоретично можливого.
1.46. У 1867 році англійський учений Д. Лістер запропонував використовувати як антисептик при хірургічних втручаннях карболку, що призвело до перевороту в медицині. Російський письменник і лікар А.П.Чехов написав про це : «Який несподіваний блиск, яка революція! Завдяки антисептиці роблять операції, які великий Пирогов вважав неможливими навіть «in spe» (тобто у майбутньому)…».
Знайдіть масові частки фенолу і метанолу в їх суміші, якщо внаслідок взаємодії 76 г такої суміші з бромною водою утворилось 13,24 г осаду.
1.47. Розбавлений розчин KMnO4 у нейтральному або лужному середовищі окиснює алкени до двоатомних спиртів – гліколів.Ця реакція була відкрита у 1887 році російським хіміком-органіком Є.Є. Вагнером і широко застосовується для виявлення подвійного карбон–карбонового звязку.
А) Написати рівняння взаємодії етену з розчином KMnO4 в нейтральному середовищі.
Б) Яку масу етан – 1,2- діолу можна добути з 336л етену (н.у),якщо вихід продукту становить 90%.
1.48. Бутиловий спирт або бутан-1-ол, міститься в сивушній олії (до 24 %). Застосовується для синтезу естерів, що мають приємний запах штучного мускусу, а також масляного альдегіду (бутаналю) та масмляної кислоти (бутанової кислоти).
Визначити масу сивушної олії, що містить 20% бутанолу та масу оцтової кислоти необхідної для приготування 46,4г бутилетаноату, якщо вихід естеру становить 80%.
1.49.У 1931 році американський хімік – органік Гомер Адкинс запропонував одержувати формальдегід окисненням метанолу киснем повітря при 250 – 400 0С у присутності каталізатора ферум (ІІІ) оксиду. Формальдегід утворюється в реакції Адкинса практично без домішок метанолу.
СН4 → СО + Н2 → СН3ОН → НСОН
А) Яку масу формаліну з масовою часткою метаналю 40 % можна добути з 500л метану (н.у.).
Б) Визначити об΄єм формальдегіду, який можна добути з 400 мл метанолу з масовою часткою 20 % (ρ = 0,8 г/мл). Практичний вихід формальдегіду рахувати 100%.
1.50. Оцтова кислота відома ще з незапам΄ятних часів. Але в чистоиу вигляді її виділили лише в 1700 році, хоча до цього користувалися її водним розчином. Утворюється вона дуже просто – унаслідок прокисання вина. Цією речовиною заправляли один з відомих французьких салатів – вінегрет («кисле вино» ( з франц.) звучить «він егр»).
Які маси розчинів оцтової кислоти з масовою часткою СН3СООН 90% і 10 % потрібно взяти для добування розчину масою 200г з масовою часткою кислоти 40%
1.51. Саліцилова, або о-гідроксибензойна кислота отримала назву від латинської назви верби – Salix. У 1873 році німецький хімік Кольбе відкрив простий спосіб її синтезу, який до нашого часу у великих масштабах застосовується у промисловості.
C6H5OH → C6H5ONa → HOC6H4COONa → HOC6H4COOH
Яку масу саліцилової кислоти можна добути з 47 кг фенолу, якщо втрати на кожній стадії виробництва становлять 54%.
1.52. Довгий час споживання цукру вважалося ефективним засобом при різних захворюваннях серцево-судинної, нервової і травної систем. В останні роки дослідники схиляються до необхідності обмеження вживання цього продукту, адже він призводить до збільшення холестерину і цукру в крові. Знайдіть масову частку цукру в склянці,якщо в ньому на 200 грамів води припадає 3 чайні ложки цукру. Маса цукру в 1 чайній ложці дорівнює 10 грам.
1.53. Історія продукту, що одержав назву морозиво, почалася дуже давно, ще за 3000 років до нашої ери в Китаї. Десерти з лимона, води і натуральних смакових речовин, молока, а також змішані зі снігом або льодом фруктові соки, натуральні або підсолоджені – рятували від жари жителів Китаю. Рецепт смачного засобу від жари поступово поширювався по всій Центральній Азії. Європа дізналася про заморожений десерт від Марко Поло, що був свідком продажу морозива в магазинах Китаю. Як подарунок монгольського Кублай-хана Поло привіз рецепт готування морозива – замороженого щербетоподібного блюда, що поповнило перелік самих вишуканих блюд італійської знаті. Але поряд з тим з морозива можна приготувати безліч інших страв . Як?
Давайте порахуємо яку масу молока 10 % жирності і пломбіру 30% жирності треба взяти, щоб приготувати 100 грам 20 % розчину новорічного коктейлю?
1.54. «Сухий спирт», що використовується в хімічних лабораторіях, є кристалічною речовиною із солодкуватим смаком. Під час горіння утворює жовтувато – блакитне полум΄я. Це суміш уротропіну з невеликою кількістю парафіну. Вперше цю речовину синтезував Бутлеров ще в 1860 році. «Сухий спирт» дуже зручний. Після згоряння не залишає попелу, тому що всі продукти його згоряння є газоподібними речовинами: вуглекислий газ, азот, водяна пара.
Визначити формулу уротропіну, що містить 51,43% Карбону, 40% Нітрогену, а решта Гідроген. Який об΄єм азоту (н.у.) виділиться, якщо згорить 2,8 г «сухого спирту». (Вважати як чистий уротропін).
1.55.Під час обробки целюлози сумішшю нітратної і сульфатної кислот утворюється піроксилін, з якого одержують бездимний порох.
Яку масу целюлози і який об’єм розчину з масовою часткою нітратної кислоти 94,5% та густиною 1,5г/мл потрібно взяти для добування тринітроцелюлози масою 118,8 кг.
2. Задачі екологічного змісту
2.1. Водень можна розглядати і як звичайне, хімічне, але найкалорійніше пальне. Теплота згоряння водню – приблизно121000кДж/кг – майже втричі більша, ніж у нафти й нафтопродуктів. Ще Костянтин Едуардович Ціолковський вважав водень за пальне для двигунів майбутнього.
Виходячи з термохімічного рівняння реакції горіння:
H2 (г) + ![]() О2 (г) = H2O (г), ∆Н = - 242 кДж,
О2 (г) = H2O (г), ∆Н = - 242 кДж,
розрахувати кількість теплоти, що виділиться при спалюванні:
а) 4 моль; б) 4 г; в) 4 л (н.у.) водню, г)питому теплоту згоряння водню.
2.2. Водень є екологічно чистим паливом, яке не забруднює довкілля, бо при його спалюванні утворюється вода: 2H2 + O2 = 2H2O. При згорянні водню, в розрахунку на одиницю маси, виділяється кількість енергії, яка в 3,3 рази більша, ніж при спалюванні рідких вуглеводнів нафти, в 2,6 рази більша, ніж при спалюванні природного газу.
Обчисліть об’єм (н.у.) кисню, який затрачається на спалювання 224 л. водню, і масу води, яка при цьому утворюється.
2.3. У монацитовому піску, який довгий час був головною гелійовмісною сировиною, міститься радіоактивний елемент торій, при розпаді якого утворюється гелій, який за густиною поступається тільки водню, але має перед воднем перевагу: він негорючий і хімічно інертний.
Допишіть рівняння ядерної реакції і зобразіть її у скороченій формі:
![]() →
→![]() + ?
+ ?
2.4. Людина вдихає повітря, до складу якого входять 21 % кисню, 0,3 % вуглекислого газу та 78,97 % азоту. Під час вдиху в стані спокою у легені людини потрапляє 500 мл повітря.
Обчисліть об’єм кисню та об’єм вуглекислого газу у цій порції повітря.
2.5. У стратосфері на висоті 20-30 км знаходиться шар озону О3, що захищає Землю від потужного ультрафіолетового випромінювання Сонця. Якби не «озоновий екран» в атмосфері, то фотони з великою енергією досягали б поверхні Землі і знищували на ній все живе. Підраховано, що в середньому на кожного жителя мегаполіса в повітряному просторі над містом (аж до верхньої межі стратосфери) припадає по 150 моль озону.
Скільки молекул О3 (озону) припадає в середньому на одну людину?
2.6. У природі озон утворюється з молекулярного кисню під дією ультрафіолетових променів у стратосфері на висоті 15-30 км над рівнем океану. Озоновий шар дуже розріджений і якби його вдалося стиснути при звичайному атмосферному тиску, він мав би товщину всього 2-3 мм! Озон – надійний щит від і смертоносних короткохвильових ультрафіолетових променів.
Відносна густина газу за повітрям 1,655. Визначити його густину та відносну густину за воднем.
2.7. У нижніх шарах атмосфери утворення незначних кількостей озону спричинюється блискавками, чим і пояснюється відчуття свіжості в повітрі після грози.
Змішали 8 г кисню та 24 г озону. Визначити об’ємний та масовий склад одержаної суміші.
- На початку 90-х років у Франції (м. Ам’єн) запущено першу в Європі установку біологічного розкладу твердих побутових відходів з утворенням біогазу. Із 1 твідходів одержують до 100 м3 біогазу.
Обчисліть об’єм кисню, необхідний для спалювання цього газу, якщо вміст метану в ньому становить 70%.
- Бурий газ NO2, є шкідливим відходом хімічного виробництва, який викидається в атмосферу заводами, що виробляють нітратну кислоту. Обчисліть, яку масу нітратної кислоти можна було б отримати додатково, якщо щороку в Україні викидається в середньому 300 тис. т нітроген(IV) оксиду, якби вдалося вловити 95 % цього оксиду. У чому виявляється його фізіологічна дія на організм людини?
- Промисловими підприємствами в атмосферу викидається нітроген(ІV) оксид. Але найбільшими джерелами NO2 є двигуни внутрішнього згоряння, теплові електростанціїі, в меншій мірі, заводи з переробки целюлози. Бутанові газові, обігрівачі та печі є також джерелами NO2. Діоксид утворюється, також, і в результатіядерних випробувань, і відповідає за червоний колір грибовидної хмари. За звичайних умов є газом червоно-бурого кольору, з характерним гострим запахом. Небезпека дії NO2 підвищується в містах, де він взаємодіє з вуглеводнями вихлопних газів і утворює фотохімічний туман – смог. Ознакою отруєння нітроген (ІV) оксидом є легкий кашель. Контактуючи з вологою поверхнею слизових оболонок цей оксид утворює нітратну і нітритну кислоти (HNO3 і HNO2), які спричиняють набряк легень.
Обчисліть масу нітратної та нітритної кислоти, що утвориться з 500 мл нітроген (ІV) оксиду (н.у.).
- Нітроген(IV) оксид належить до шкідливих відходів хімічного виробництва. У вигляді “лисячого хвоста” бурий газ викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого. Одним із хімічних способів боротьби з “лисячими хвостами” є розклад нітроген(IV) оксиду на азот і кисень за допомогою каталізаторів (наприклад, паладованого алюміній оксиду).
Складіть рівняння реакції й обчисліть об’єм (н.у.) кисню, який можна добути з 448 м3 нітроген(IV) оксиду.
- Встановлено, що для очищення газових викидів від нітроген діоксиду застосовується натрій карбонат, який під час взаємодії з NO2 дає натрій нітрат, натрій нітрит і вуглекислий газ.
Обчисліть масу натрій карбонату, який знешкоджує викиди, що містять 5 л NO2 (н.у.)
2.13. Розлиту ртуть можна зібрати за допомогою мідного дроту, алюмінієвої фольги й навіть аркуша паперу. Однак у всіх цих випадках зібрану ртуть потрібно знешкодити (наприклад, обробити концентрованою нітратною кислотою).
Яка кількість нітратної кислоти потрібна для знешкодження 19,5 г ртуті, зібраної на підлозі після того, як у будинку був розбитий термометр? Визначте об’єм газу (н.у.), що виділиться при цьому.
2.14. Безбарвна кристалічна речовина використовується як азотне добриво, як сировина в деяких хімічних виробництвах та для годівлі худоби.
Виведіть найпростішу формулу речовини, до складу якої входить Гідроген, Карбон, Оксиген і Нітроген у масовому співвідношенні 1:3:4:7. Вкажіть кількість атомів у молекулі цієї сполуки. Назвіть її.
- Близько третини мінеральних добрив, що вносяться в грунт, вимиваються з нього дощовими водами й виносяться річками в моря й океани. Лише Нітрогену і Фосфору таким шляхом потрапляє у Світовий океан близько 62 млн. тонн на рік. Це призводить до бурхливого розвитку деяких одноклітинних водоростей, що вже не раз спричиняло так звані червоні припливи. При “підживленні” нітратами й фосфатами морської води ці рослини надзвичайно швидко розмножуються, утворюючи подекуди на поверхні води гігантські “ковдри” товщиною до 2 м і площею багато квадратних кілометрів. Гинучи, водорості опускаються на дно, де починають гнити, поглинаючи весь кисень з води. Це спричиняє загибель донних організмів.
Запишіть формули відомих вам азотних і фосфатних добрив. Обчисліть, яка із селітр містить найвищу масову частку Нітрогену: натрієва, калієва, кальцієва чи аміачна.
2.16.Фосфін – неорганічна речовина, безбарвний газ із різким запахом гнилої риби, є токсичною речовиною, використовується як хімічна зброя. Його токсична дія проявляється при потраплянні до організму – шляхом інгаляції або через стравохід у вигляді сполуки-супутника фосфідів (можуть використовуватися у складі пестицидів). Симптомами отруєння є нудота, болі в животі, озноб, спрага, ускладнене дихання, головний біль. За ними можуть слідувати конвульсіїабокома.
А) Елемент знаходиться в V групі головній підгрупі. Відносна молекулярна масса його леткої сполуки з Гідрогеном дорівнює 34. Визначте елемент. У відповіді вказати кількість нейтронів.
Б) Масові частки Фосфору і Гідрогену становлять 91,18% і 8,82%. Встановити формулу сполуки.
В) Магній фосфід масою 60,3г обробили хлоридною кислотою, фосфін, який утворився повністю згорів. Визначити масу одержаної ортофосфатної кислоти.
2.17. Причиною появи «блукаючих вогників», які інколи можна спостерігати на болотах, є сполуки Фосфору та Гідрогену,що утворюються в процесі гниття органічних речовин і самозаймаються на повітрі.
Встановіть формулу однієї такої сполуки, коли відомо,що відносна молекулярна маса її дорівнює 34,а масові частки Фосфору і Гідрогену,відповідно становлять 91,2 та 8,8%.
2.18. Існує думка, що сульфатну кислоту добувають тільки штучно. Однак вона є в природних водах вулканічного походження. Так, вода південноамериканської річки Ель Ріо Винагре («Кисла»), що бере початок поблизу діючого вулкана Пурасе у Кордильєрах, містить 0,1% сульфатної кислоти. Щороку річка виносить в океан до 20 т H2SO4. А в тілі деяких равликів уміст сульфатної кислоти становить 4%.
Обчисліть масу сульфатної кислоти, яка міститься в 400 мл розчину з масовою часткою кислоти 60% ігустиною 1,5 г/см3.
2.19. Мідний купорос CuSO45H2O широко застосовується у сільському господарстві. Властивості мідного купоросу дозволяють його з успіхом використовувати для боротьби із хворобами і підвищувати врожайність садових і городніх рослин. Цей препарат відносно недорогий, ефективний і перевірений садівниками протягом багатьох років. Обробка дерев мідним купоросом дозволяє боротись із бактеріальними і грибковими хворобами, а Купрум важливий елемент для нормального росту і плодоношення рослин. Цей мікроелемент сприяє підвищенню рівня цукру в плодах рослин і крохмалю в картоплі. Оброблені рослини мають кращий імунітет. З метою підживлення рослин, а також для профілактики хвороб і при ознаках нестачі Купруму (скручення пагонів, хлорос на листках) використовується слабка концентрація 3 грами мідного купоросу на 10 л води. З лікувальною метою готують 0,5-1% розчини мідного купоросу (50-100 грам порошку на відро води). Таким розчином добре обробляти рани на корі дерев із різноманітними хворобами рослин (парша, клястероспориоз, антракноз, курчавість, коккомікоз, п’ятнистість, мониліоз, філостиктоз, різніцвілі, та ін).
Обчисліть масову частку безводної солі у зазначених розчинах.
2.20. Одним із процесів очищення питної води є знезараження її хлором (0,002 мг хлору на 1л води). У результаті хлорування велика кількість мікроорганізмів у такій воді гине. Поясніть суть цього процесу.
Визначте масу хлору, що використовується на хлорування денної норми (350 л) води для шести осіб.
2.21. Перш ніж вилити в каналізацію рідкі відходи лабораторних робіт, що містять хлоридну кислоту, потрібно їх нейтралізувати натрій гідрооксидом або содою.
Визначте маси NaOH і Na2CO3 , необхідні для нейтралізації відходів, що містять 0,45 моль хлоридної кислоти. Який об’єм газу (н.у.) виділиться під час нейтралізації зазначеної кількості відходів содою?
2.22. Вільний хлор застосовують у хімічній промисловості для стерилізації води, знезараження стічних вод, відбілювання тканин, целюлози, яку використовують для виготовлення паперу.
Який об’єм хлору(н.у.) можна добути, якщо на 300мл розчину хлоридної кислоти з масовою часткою хлороводню 14,6% та густиною 1,07 г/мл (IV) подіяли манган оксидом.
2.23. Фтороводень, що міститься в газоподібних відходах, уловлюють фільтрами і поглинають розчином їдкого натру з масовою часткою NaOH 5%. Скільки кілограмів фтороводню було поглинуто на заводі за добу, якщо для цього використано розчин їдкого натру масою 2,5 т?
2.24. Вода, що її використовують для господарсько-питних потреб, з вмістом фтору менше 0,5 мг/л, додатково фторується.
Визначте масу 2,5% розчину натрій фториду, виготовленого з розчину натрій фториду з масовою часткою речовини 0,9 необхідного для фторування 1000 м3 природної води з вмістом фтору 0,4 мг/л до санітарної норми 0,8 г/м3.
2.25. У промисловості свинець одержують із мінералу свинцевий блиск PbS. Для одержання 1 т свинцю випалюванням свинцевого блиску витрачається 162,3 м3 кисню.
Скільки гектарів букового лісу треба виростити, щоб компенсувати кисень, витрачений на виробництво 1000 т свинцю, якщо 100-річне дерево продукує за рік 560 м3 кисню, а на 1 га лісу росте до 200 дерев?
2.26. Внаслідок спалювання горючих копалин в атмосферу потрапляє значна кількість вуглекислого газу. Це спричиняє негативні екологічні наслідки, зокрема парниковий ефект.
Обчисліть, який об’єм карбон (IV) оксиду потрапить в атмосферу при спалюванні 100 м3природного газу, якщо його склад такий: метан – 97,7%, етан – 0,2%, пропан – 0,1%, сірководень – 2% (за об’мом).
2.27. Біоенергетика – це галузь енергетики, що базується на використанні біологічного палива, яке належить до відновлювальних джерел енергії. Біогаз, що утворюється в біогазових установках шляхом метанового бродіння, є сумішшю метану (60-70%) й вуглекислого газу (30-40%), іноді з домішками сірководню (до 3%).
Який об’єм (н.у.) кисню затрачається на спалювання 20 м3 біогазу складу: метан – 60%, вуглекислий газ – 38%, сірководень – 2%?
2.28. Побутове сміття виділяє газ, макрокомпонентами якого є метан (40 - 70%) і карбон(IV) оксид (30 – 60%).
Яка кількість теплоти виділиться в разі спалювання 2 т сміття, що містить 70% метану, якщо під час згоряння 1 моль метану виділяється 880 кДж теплоти?
2.29. У питній воді були виявлені сліди речовини, яка має токсичну дію. На основі якісного і кількісного аналізу було встановлено, що масові частки елементів у ній становлять: С – 55 %, Н – 4,2 %, О – 14,8 %, СІ – 27 %. Установіть молекулярну формулу речовини.
2.30. Целюлоза або клітковина – головний компоненнт клітинної стінки вищих рослин. У волокнах деривини її вміст дорівнює 40-50%. Виділення целюлози з деревини – складний технологічний процес, який є потужним джерелом забруднення повітряних та водних басейнів. При нагріванні з розбавленими кислотами целюлоза піддається гідролізу, утворюючи глюкозу.
Обчисліть масу глюкози добутої при гідролізі деревних стружок масою 250 кг, масова частка целюлози в яких становить 55%.
- Бензен, фенол та анілін – сполуки, що у складі питної води можуть потрапити в організм людини й спричинити серйозні порушення.
Бромною водою обробили 50 г суміші бензену, фенолу й аніліну. Утворився осад масою 9,91 г. При дії металічного натрію на таку саму масу суміші виділилось 0,112 л. водню (н.у.). Які масові частки (у відсотках) компонентів у суміші?
2.32. Колись фенол вважали одним з найважливіших антисептиків і широко використовували для дезінфекції приміщень, меблів, хірургічних інструментів. Знезаражування у лікарській справі за допомогою фенолу було відкрите і широко впроваджене британським хірургомДжозефом Лістерому 1860-х роках. Він обробляв фенолом не лише відкриті рани, а й хірургічні інструменти, завдяки чому зміг скоротити кількість летальних випадків під час операцій з 50 до 15%. Дотепер збереглася тривіальна назва фенолу — карболова кислота. Зараз фенол рідко виступає в ролі антисептика, його замінили інші речовини. Натомість усе більше й більше зростає роль фенолу в синтетичній промисловості. З фенолу добувають капролактам, який застосовують для виробництва пластмас та синтетичного капронового волокна, разом з формаліном із нього добувають фенол-формальдегідні смоли. На основі фенолу добувають вибухові речовини, наприклад пікринову кислоту. Окрім того, деякі феноли — гідрохінон, пірокатехін та пірогалол — застосовують у виробництві хімреактивів для фотографічних процесів. Феноли є одним з найбільш поширених забруднювачів навколишнього середовища.
Виведіть молекулярну формулу сполуки класу фенолів, яка разом з відходами хімічних виробництв потрапляє у стічні води, забруднюючи їх, якщо відомо, що відносна густина її пари за киснем дорівнює 3,375. Масова частка Карбону становить 77,78%, масова частка Гідрогену – 7,41%.
3. Задачі біологічного характеру
3.1. Чи знайомі вам вислови: «напитися повітря», «повітря, що дзвенить», «це нам потрібно, як повітря»? Кожне з них по – своєму підкреслює особливу значимість повітря в нашому житті, ставлення до нього. Значення повітря й кисню в ньому не завжди було відомо людям, і те, що в герметично закритому приміщенні 2 м3 його вистачить лише на годину одній людині. Так, у 1846 році на судні «Мері Сомс» загинув батальйон солдат, які укрилися в трюмі, хоча судно залишилося абсолютно неушкодженим.
Один гектар зелених насаджень забезпечує здорове дихання 30 людям. Скільки моль кисню виділяють зелені насадження, якщо одна людина споживає 12 кг повітря за добу.
3.2. Ще за 3000 років до нашої ери в Давньому Китаї для лікування захворювань щитовидної залози застосовували спалені морські губки й водорості. Гіппократ указував на цілющі властивості морських водоростей у разі «зобу». У Китайському кодексі 1567 р. до н. е. також містяться аналогічні рекомендації. Іод став другим після заліза мінералом, визнаним життєво необхідним для людини. Добова потреба в Іоді становить 3 мг/кг.
Обчислити масу Іоду, необхідну для забезпечення організму масою 60 кг.
3.3.Кам΄яна або кухонна сіль – сировина для добування хлору, водню, металічного натрію, натрій гідроксиду. Застосовується у харчовій, шкіряній промисловості, миловарінні, в медицині як фізіологічний розчин, що являє собою 0,85% - й розчин натрій хлориду.
А) Аптекар – провізор розчинив у 100 л дистильованої води 860 г натрій хлориду. Яка масова частка солі в одержаному розчині.? Як виправити помилку аптекаря – провізора?
Б) Напишіть рівняння реакції добування хлору, водню, металічного натрію та натрій гідроксиду з кухонної солі.
3.4. Хлоридна кислота створює кисле середовище в шлунку хребетних тварин і людини, забезпечуючи активність ферментів шлункового соку. У людей, у шлунку яких хлоридної кислота виробляється недостатня кількість, порушуються процеси перетравлювання білків, можливе розмноження у шлунку великої кількості шкідливих бактерій тощо. Збільшення секреції хлоридної кислоти також небезпечне для організму людини, зокрема воно спричиняє печію.
Визначте масу хлоридної кислоти з масовою часткою хлороводню 0,2, яку можна одержати з 56 л водню (н. у.) та 28 л хлору (н. у.).
3.5.Наявність у повітрі об΄ємної частки сірководню 0,1% викликає отруєння. Лише один подих сірководню може спричинити непритомність, параліч дихального центру. Отруйна дія пояснюється його здатністю взаємодіяти з Ферумом гемоглобіну крові.
А) Запропонуйте два способи добування сірководню в лабораторії, якщо є тільки три реактиви S, Zn, HCI і необхідне обладнання. Для окисно – відновних реакцій складіть схеми електронного балансу.
Б) Який об΄єм сірководню (н. у.) утвориться при взаємодії 1 т цинкової обманки, що містить 20 % домішок з розчином хлоридної кислоти.
3.6.Під час рентгеноскопічного дослідження організму людини застосовують так звані рентгеноконтрасні речовини. Так, перед просвічуванням шлунка пацієнту дають випити суспензію важкорозчинного барій сульфату, який не пропускає рентгенівське випромінювання.
Які кількості барій хлориду та сульфатної кислоти будуть необхідні для одержання 93,2 г барій сульфату?
3.7.Нітроген (І) оксид – наркотик. Вдихання «веселильного газу» приводить людину в стан сильного збудження, сп’яніння. Нітроген (ІV) оксид – паралізує роботу серця.
Визначити, в якому оксиді масова частка Нітрогену є більшою.
3.8. У природі нітроген (ІІ) оксид може утворюватись під час грози або за дуже високої температури. За підвищеної концентрації цей оксид діє як хімічний мутаген: він змінює кількість хромосом у клітині, завдяки чому утворюється поліпоїд. Використовується в селекції рослин і мікроорганізмів.
Обчислити об΄єм газу (н. у.), який утворюється при взаємодії міді масою 9,6 г з розбавленою нітратною кислотою.
3.9.Аргентум нітрат(«пекельний камінь») використовують в медицині, як засіб для стерилізації ран, видалення дрібних бородавок, а також в аналітичній хімії для виявлення аніонів Cl- ,Br- , I- , PO43- Його одержують розчиненням срібла в конценрованій нітратній кислоті.
А)Написати рівняння окисно-відновної реакції добування AgNO3.
Б)Визначити масу срібла та об’єм кисню, які можна одержати термічним розкладом 34г аргентум нітрату.
В)Змішали 350г розчину аргентум нітрату з масовою часткою солі 17% і 350г розчину калій хлориду з масовою часткою солі 8%. Визначте і вкажіть масу осаду, що утворився.
3.10. Ляпіс або аргентум нітрат у часи алхіміків називали «пекельним каменем». Він має в΄яжучу та бактерицидну дію. Широко застосовують у хімічних лабораторіях для визначення в розчинах йонів галогенів, а також у медицині, наприклад для виведення бородавок.
Обчисліть масу осаду, що утворився при змішувані 10 г розчину аргентум нітрату з масовою часткою солі 30% з розчином калій масою 15,5г з масовою часткою солі 3%.
3.11. Академік Ферсман назвав Фосфор «елементом життя і думки». Фосфор виявлено в усіх органах зелених рослин: стеблі, корінні, листі, але найбільше його в плодах і насінні. Рослини накопичують Фосфор і постачають ним тварин. В організмі тварин Фосфор зосереджений головним чином у скелеті, м΄язах і нервових тканинах.
Визначте масу Фосфору в 50 кг кісток, що містять 58% кальцій ортофосфату.(5,8 кг)
3.12. Якщо палаючий білий фосфор потрапляє на шкіру або в очі, уражені місця негайно промивають 5% розчином мідного купоросу. На рану накладають мокру пов’язку, просочену цим самим розчином.
А) Мідний купорос масою 50г розчинили у воді масою 350г. Визначити масову частку купрум (ІІ) сульфату в добутому розчині.
Б) Визначте масу води, в якій слід розчинити 75г мідного купоросу для одержання розчину купрум (ІІ)сульфату з масовою часткою речовини 4%.
3.13. Карбон (ІІ) оксид (чадний газ) прискорює цвітіння огірків, регулює стать квіток. Обробивши ним рослини огірків, одержують більш ранній і вищий урожай. Завдяки відновним властивостям його застосовують у металургії під час виплавляння чавуну, добування металів з руд.
Визначити об΄єм карбон (ІІ) оксиду (н. у.) необхідного для повного відновлення 8 кг ферум (ІІІ) оксиду.
3.14. Атмосфера з вуглекислого газу пригнічує життєдіяльність бактерій і грибів, дихання плодів і насіння, поліпшує їх зберігання та продовжує його строки. Використовується вуглекислий газ для знищення шкідників зерна й борошна. Для збереження сільськогосподарської продукції як джерело холоду можна використати «сухий лід».
Яку масу «сухого льоду» можна отримати внаслідок охолодження 100 м3 повітря, вміст вуглекислого газу в якому приблизно дорівнює 0,33 %?
3.15. Силіцій належить до мікроелементів організму людини (2,1г на 70 кг маси тіла людини) і міститься в крові, лімфатичних вузлах, кришталику ока, м’язах шлунка, підшлунковій залозі, кістковій тканині, зубах. Добове надходження Силіцію з їжею становить 3,5 мг, а з повітрям – близько 15мг. Водночас деякі його сполуки згубно діють на організм людини. Найнебезпечнішими є азбест, який спричиняє захворювання шкіри, легень (азбестос). До складу азбесту входить сіль магній метасилікат.
Визначте формулу сполуки в якій співвідношення маси Mg, Si та O становить відношенню 6:7:12.
3.16.Елемент Натрій бере участь у процесах водного внутрішнього та міжклітинного обміну. Добова потреба організму в Натрію – 1 г, що задовольняється за рахунок кухонної солі в раціоні харчування. Проте підвищене вживання солі спричиняє розвиток гіпертонічної хвороби. Обчисліть маси солі та води для приготування 250 г розчину з масовою часткою натрій хлориду 15 %. (37,5 г, 212,5 г)
3.17. Калій – основний внутрішньоклітинний катіон, який виконує важливу роль у творенні потенціалу під час роботи біологічних мембран. В організмі людини загальна кількість Калію становить 16 -150 г.
Визначте масову частку калію в організмі людини, маса якої 60 кг. (0,26 – 2,5%)
3.18. Елемент Кальцій – основний елемент кісткової тканини. Він є активатором ферментів, бере участь у реакції зсідання крові та багатьох біологічних процесах. Добова потреба дорослої людини в Кальції – 800 мг. Багато його в молоці, сирах. Кальцій добре засвоюється за наявності Фосфору (у співвідношенні 1:1.5).
Знайдіть масову частку Кальцію та Фосфору в кальцій ортофосфаті. (38,7% Са, 20% Р)
3.19. У XVI столітті аптекарі називали «Венерою» якийсь метал, який поліпшує роботу серцево-судинної системи. Браслети з цього металу використовують як засіб для стабілізації артеріального тиску.
Метал має червонуватий відтінок. Що це за метал? Скільки атомів його міститься в порції кількістю речовини 0,2 моль?
3.20. Якщо повільно гояться рани, шкіра вугрувата, поганий зір, слух, найімовірніше в організмі не вистачає Цинку – речовини, яка входить до складу 200 ферментів. Він необхідний для імунної системи, гарної юнацької шкіри, нормального росту і розвитку, формування ендокринної системи. У тілі людини масою 70 кг міститься 1,0 – 2,5 г Zn2+.
Обчисліть число йонів Цинку в організмі.
3.21. Цинк міститься майже у всіх тканинах рослин і тварин. Недостатня кількість цинку може призвести до затримки росту молодого організму, а при його нестачі в землі виникають захворювання багатьох рослин. Цинк входить до складу деяких ферментів, він необхідний для нормального функціонування залози гіпофізу, регулює жировий обмін.
Суміш цинку та міді масою 5 г помістили розчин сульфатної кислоти. Виділилось 0,896 л водню (н. у.). Визначте масову частку цинку у вихідній суміші.
- Чи знаєте ви, що існують живі організми, здатні харчуватися залізом ?
У давнину в багатьох місцях залізну руду добували з дна озер. Витягнуть руду повністю, а через певний час вона з’являється знову. Виявляється, ці колосальні відклади – результат діяльності залізобактерій.
А) Яку руду вигідніше використовувати для одержання заліза: магнітний залізняк – Fe3O4 чи шпатовий залізняк – FeCO3 за однакової їх собівартості?
Б) Обчисліть масу заліза, яке можна одержати з 350т червоного залізняку (Fe2O3), в якому масова частка пустої породи становить 20%.
3.23. Для нормального розвитку дитина повинна щодоби з харчовими продуктами отримувати 2 мг Феруму. Скільки ягід полуниці вона повинна з’їсти, якщо відомо, що середня маса ягоди 50 г, а вміст Феруму становить 0,54 мг/100 г?
3.24. Елемент Кобальт бере участь у творенні інсуліну, еритроцитів і гемоглобіну, входить до складу ферментів і активує їх. Добова потреба організму людини в цьому елементі – 16 – 40 мг/кг. Найбільше Кобальту містять горох, буряк, червона смородина, полуниця, морські водорості.
Визначають йони Кобальту з допомогою карбонат – іонів. Складіть молекулярне, повне та скорочене йонні рівняння.
3.25. Елемент Станум в організмі людини міститься у формених елементах крові. Добова потреба людини в ньому – 17 мг. Багато цього елемента міститься в насінні соняшнику й гороху, у буряках, картоплі, у рибі родини тріскових.
Йон Стануму можна визначити з допомогою сульфід–йонів. Складіть молекулярне, повне та скорочене йонні рівняння.
3.26. Розлита ртуть починає повільно випаровуватися. Ртутна пара згубно діє на живі організми і поступово розвивається тяжке хронічне отруєння. Кришаться і випадають зуби, випадає волосся, людина чахне. Ртуть, що закотилася в щілини, нейтралізують хімічним способом. Для цього всі щілини засипають сірчаним цвітом( сірка).
Визначити масу сірки необхідної для нейтралізації 4г ртуті.
3.27. Розлита ртуть викликає білокрів’я. Процес цієї смертельної хвороби дуже нагадує туберкульоз. Ртуть найкраще нейтралізувати концентрованим розчином FeCl3.
Hg + FeCl3 = Hg2Cl2+FeCl2
У відповіді вказати кількість приєднаних електронів.
3.28. 1,2–дихлороетан – безбарвна або злегка зелена отруйна рідина з солодкуватим запахом, має наркотичні властивості, викликає тяжкі ураження печінки. Уперше отримано в Голандії («голандська рідина») у 1795 році. Є сировиною для органічного синтезу.
А)Здійснити перетворення:
Алюміній карбід → метан → етен → 1,2–дихлороетан →етан–1,2–діол
Б) Алкен масою 2,8 г може приєднати 2,24 л хлору (н. у.). Розрахувати об΄єм кисню, що витратиться на спалювання 10 л цього вуглеводню. Виміри об΄ємів газів проводили за нормальних умов.
В). Взаємодією 448 л етену і 560 л хлору добули 1,68 кг 1,2–дихлороетану. Визначити масову частку практичного виходу галогеноводню.
3.29. 12 листопада 1847 року в університеті Единбурга професор Д. Сімпсон провів першу операцію під наркозом хлороформом. Хлороформ є отрутою для печінки. За півгодини наркозу функція печінки пошкоджується на тиждень, а після наркозу протягом двох годин потрібне відновлення протягом місяця. У разі тривалішого наркозу пошкоджуються нирки.
Який об’єм хлороформу густиною 1,5 г/мл можна добути з природного газу об’ємом 672л(нормальні умови), якщо об’ємна частка метану в якому становить 96%? Вихід хлороформу становить 75% від теоретично можливого.
3.30. Хлороформ одержують дією хлорного вапна на ацетон, спирт або ацетальдегід, а також каталітичним хлоруванням метану (разом із моно-, ди- й тетрахлорометаном). Застосовують як розчинник жирів, лаків. У лабораторних дослідженнях хлороформ необхідний майже повсюдно.
Розрахуйте масу трихлорометану, який можна добути під час хлорування метану об’ємом 33,6л молекулярним хлором, об’єм якого у реакційній системі дорівнює 134,4л. Об’єми газів приведені до нормальних умов. Вихід продукту становить 70% від теоретично можливого.
3.31. Рідкий бензен і його пари дуже отруйні. Вдихання парів бензену викликає запаморочення і головний біль. Короткочасне збудження змінюється коматозним станом; виникають судоми, розширення зіниць, порушення дихання, ритму серця, зниження артеріального тиску. Рідкий бензен проникає в організм через шкіру, і це може спричинити отруєння. Робота з бензеном та його гомологами вимагає особливої обережності.
Гомолог бензену, масою 5,3 г спалили, добувши карбон (VI) оксид об΄ємом 8,96 л (н. у.). Визначте формулу вуглеводню. Напишіть структурні формули можливих ізомерів.
3.32. У 1747 році берлінський аптекар Маргреф показав, що в соку кормового буряка кількість цукру досягає 6% і, що можливе технічне його одержання. Це здійснив його учень Карл Ахард у 1801 році. Перший бурякоцукровий завод виявився нежиттєздатним і припинив своє існування. 300 кг цукрових буряків, що містять 10 % цукру обробили 50 л гарячої води. Визначити масову частку цукру в одержаному сиропі, якщо ступінь вилучення цукру з буряків складає 80 %.
3.33. Довгий час споживання цукру вважалося ефективним засобом при різних захворюваннях серцево-судинної, нервової і травної систем. В останні роки дослідники схиляються до необхідності обмеження вживання цього продукту, адже він призводить до збільшення холестерину і цукру в крові. Знайдіть масову частку цукру в склянці, якщо в ньому на 200 грамів води припадає 3 чайні ложки цукру. Маса цукру в 1 чайній ложці дорівнює 10 грам.
3.34.Метиловий спирт за смаком і запахом не відрізняється від етилового, проте його дія на організм є набагато загрозливішою для нашого здоров’я. Навіть невелика кількість метанолу може призвести до сліпоти, а доза від 30 мл — до смерті. Цим пояснюються часті випадки отруєння метиловим спиртом або через незнання, або в разі вживання підробленого алкоголю. Цікаво те, що у разі такого отруєння протиотрутою є звичайний, тобто етиловий спирт. Це пов’язано з тим, що процеси зв’язування обох спиртів в організмі відбуваються за участю одного ферменту — алкогольдегідрогенази, але так як реакція з етанолом відбувається швидше, шкідливих продуктів розщеплення метанолу в крові в результаті виявляється набагато менше.
Знайдіть масову частку метанолу в суміші його з етанолом, якщо відомо, що при дії надлишку натрію на 22 г цієї суміші виділилось 6,72 л газу (н.у.).
3.35.У медицині застосовують 70% розчин етилового спирту як антисептик а, зокрема в хірургії для обробки операційного столу, рук хірурга та хірургічного інструменту, а також як лікарський засіб, що подразнює тканини організму, ослаблює або вбиває мікроорганізми.
Визначити об΄єм води та об΄єм 96%-вого спирту (ρ = 0,8 г/мл)необхідні для приготування 500 г 70% - вого розчину етанолу.
3.36. Етиленгліколь – сильна отрута. Застосовується у виглядів водних розчинів, що не замерзають, як антифриз для автомобільних радіаторів, а також як замінник гліцеролу в косметиці. Етиленгліколь викликає сп΄яніння, тому внаслідок своєї токсичності неодноразово був причиною тяжких отруєнь.
А) Визначити масу води та етиленгліколю необхідних для одержання 10 л 40% - вого розчину антифризу.
Б) Визначити масу динітрату етиленгліколю, якщо в реакцію нітрування вступило 400 г 63 % розчину нітратної кислоти і 186 г етиленгліколю. Вихід вибухової речовини становить 80%.
3.37. Мурашина кислота названа так тому, що в момент небезпеки виділяється мурахами для попередження інших мешканців мурашника, і захисту від хижаків. Дуже корисна для великих ссавців. Після зимового сну ведмеді, лягаючи на мурашник, позбавляються від паразитуючих комах. Мурашина кислота міститься в хвої, соку кропиви.
Який об΄єм розчину натрій гідроксиду з масовою часткою лугу 12 %
(ρ = 1, 116 г/мл) потрібен для нейтралізації мурашиної кислоти масою
- г ?
3.38. Відомо, що зі стародавніх часів люди розводили виноград і запасали виноградний сік або вино. Та часом воно скисало, перетворюючись на оцет. Спочатку його викидали, а потім знайшли застосування, використовуючи як приправу в їжу або лікарських цілях як жарознижувальний засіб .
Який об΄єм розчину калій гідроксиду з масовою часткою лугу 20 %
(ρ = 1, 173 г/мл) потрібно використати на нейтралізацію 10 г розчину етанової кислоти?
3.39. Сірчаний ефір – так називали в свій час алхіміки діетиловий етер. Вони вважали, що до його складу входить Сульфур, оскільки для його добування застосовується сульфатна кислота.
Визначити масу діетилового етеру, добутого з 230г етенолу, якщо вихід його становийть 85% від теоретично можливого.
3.40. Щоб квіти довше зберігалися їх часто підживлюють глюкозою або цукрозою.
Обчислити масу цукру і об΄єм води необхідні для приготування 400 г 7,42% - вого розчину цукрози.
3.41.Однією зі сполук Нітрогену, яка, потрапляючи в організм людини з тютюновим димом, викликає рак легень, є нікотин С10Н14N2. Відомо,що одна цигарка містить 50 мкг нікотину, а в пачці знаходиться 20 цигарок.
Обчислити кількість речовини нікотину, яка залишається в організмі активного і пасивного палія після використання однієї пачки цигарок. В організмі активного палія залишається 20% нікотину, а в організмі пасивного палія – 50% нікотину.
 4. Задачі на формування читацької компетентності
4. Задачі на формування читацької компетентності
4.1. У довіднику стосовно Гідрогену – водню наводяться такі дані:
А) – найлегшийгаз, він легший заповітряв 14,5 разів. Тому, наприклад,мильні бульбашки, наповнені ним, у повітрі здіймаються. Колисьдирижаблітаповітряні кулінаповнювали цим газом, але у 30-х рр. XXст. відбулося декількакатастроф, під час яких дирижаблі вибухали і згорали. В наш час дирижаблі наповнюють гелієм, попри його значно більшу вартість.
Б) – хімічний звя'зок умолекулі—ковалентий неполярний, оскільки молекулаутворенаатомамиз однаковоюелетронегативністю(атомамиодного виду).
В) – при змішуванні зповітрямутворює вибухонебезпечну суміш— так званийгримучий газ
Г) – Зареєстрований якхарчова добавкаE949(упакувальний газ, класс«інші»). Входить у список харчових добавок, які допускаються до застосування в харчовій промисловості як допоміжний засіб для виробництва харчової продукції.
Ґ) – одне з завдань водневої енергетики— забезпечення компактного та безпечного зберігання водню на борту транспортного засобу, з метою подовжитиінтервалміжзаправками.
Д) –використовуюється при виробництвіметанолу,милаіпластмас, при синтезі амоніакуNH3,гідрогенхлоридуHCl,метанолуСН3ОН, при гідрокрекінгу, як відновник при отриманні деякихметалів.
Е) –найактивніше реагує згалогенами утворює галоген оводні.
Є) –А А.Лавуазьє довів, що «горюче повітря» - проста речовина, а вода – сполука Гідрогену і Оксигену.
Ж) – він малорозчинний у воді— 18,8 мл/л,але він добре розчиняється у багатьохметалах(Ni,Pt,Pdтощо), особливо впаладії(850 об'ємів на 1 об'єм Pd).
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.2. У довіднику стосовно Гелію - гелію наводяться такі дані:
А) – істинно благородний газ, не має кольору, запаху і смаку.
Б) – протонне число дорівнює 2.
В) – у сучасному Всесвіті майже весьстворюється в результаті термоядерного синтезу із водню в зірках.
Г) – дуже погано розчиняється в крові і тому його використовують як складову частину штучного повітря, що подається для дихання водолазам.
Ґ) – на Землівін створюється в результаті альфа-розпаду важких елементів.
 Д) –використовують для створення інертної і захисної атмосфери при зварюванні, різанні і плавці металів, для наповнення звичайних повітряних кульок, дирижаблів і аеростатів, як компонент середовища гелій-неонових лазерів, як газ-носій у газовій хроматографії.
Д) –використовують для створення інертної і захисної атмосфери при зварюванні, різанні і плавці металів, для наповнення звичайних повітряних кульок, дирижаблів і аеростатів, як компонент середовища гелій-неонових лазерів, як газ-носій у газовій хроматографії.
Е) – Лок'єр дав ім'я, що відображає історію його відкриття (від грец. Helios —Сонце)
Є) – може викликати обмороження шкіри й ураження слизової оболонки очей.
Ж) – посідає друге місце за поширеністю у Всесвіті після водню — біля 23% за масою.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, які – хімічні, а які – добування ?
4.3. У довіднику стосовно Карбону – вуглецю наводяться такі дані:
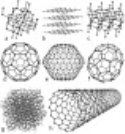 А) – у природі зустрічається як у вільному стані (алмаз, графіт, карбін і лонсдейліт, фулерен, вуглецеві нанотрубки), так і у вигляді різноманітних сполук.
А) – у природі зустрічається як у вільному стані (алмаз, графіт, карбін і лонсдейліт, фулерен, вуглецеві нанотрубки), так і у вигляді різноманітних сполук.
Б) – як адсорбент застосовується і в сучасних протигазах .
В) – на Сонці він посідає 4-е місце за поширеністю після Гідрогену, Гелію та Оксигену.
Г) –відомо понад 100 мінералів , серед яких найпоширеніші карбонати кальцію, магнію і феруму

Ґ) – алотропні модифікації — алмаз і графіт.
Д) – біологічний цикл закінчується або окисненням і поверненням в атмосферу, або похованням у вигляді вугілля або нафти.
Е) – становить 0,1% масиземної кори, накопичується у верхній частині земної кори, де його присутність пов'язана в основному з живою речовиною, кам'яним вугіллям, нафтою, антрацитом, а також з доломітами і вапняками
Є) – алмаз завдяки своїй надзвичайній твердості широко застосовується при бурінні твердих гірських порід, обробці твердих металів і їх сплавів.
Ж) –. має валентність ІІ, ІV.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.4. У довіднику стосовно Нітрогену – азоту наводяться такі дані:
А) – загальний вміст в земній корі становить 1•10−2 % за масою.
Б) – утворює кілька оксидів (N2O, NO, N2O3, NO2, N2O4, N2O5).
В) – велика частина його застосовується для виробництва амоніаку.
 Г) – при звичайних умовах досить пасивний, малоактивний; при високих температурах і тиску, при наявності каталізаторів утворює сполуки з воднем, металами, киснем.
Г) – при звичайних умовах досить пасивний, малоактивний; при високих температурах і тиску, при наявності каталізаторів утворює сполуки з воднем, металами, киснем.
Ґ) –безбарвний газ без запаху і смаку, (киплячий азот) кипить при температурі −195,8 °C, замерзає при −209,86 °C.
Д) – не підтримує ні дихання, ні горіння.
Е) – в Періодичній системі Д.І. Менделєєва знаходиться в V групі, головній підгрупі, з протонним числом 7.
Є) – один із основних складових живої природи, він входить до складу амінокислот, з яких формуються білки, та нуклеїнових кислот.
Ж) – як складова одержана з повітря, використовується у виробництві амоніаку, нітратної кислоти, добрив.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, які – хімічні, а які – добування ?
4.5. У довіднику стосовно Оксигену – кисню наводяться такі дані:
 А) – відомо близько 1400 мінералів, головні з них—кварц, польові шпати, слюда, глинисті мінерали карбонати.
А) – відомо близько 1400 мінералів, головні з них—кварц, польові шпати, слюда, глинисті мінерали карбонати.
Б) – алотропні модифікації — кисень і озон.
В) – займає 3-є місце після Гідрогену і Гелію за поширеністю у Всесвіті.
Г) –у промисловості добувають фракційною перегонкоюрідкого повітря і електролізом води.
Ґ) –газ – застосовується в металургії для інтенсифікації доменних і сталеплавильних процесів, при виплавці кольорових металів у шахтних печах Д) –принормальних умовах— газ, що складається з двоатомних молекул, без запаху і смаку, при температурі —183°С він скрапляється у блідо-блакитну рідину, яка при —218,7°С замерзає в синю кристалічну масу.
Е) –використовують як окисник для деяких різновидівракетних палив.
Є) –головний чинник, який регулює розподіл елементів у планетарному масштабі, вміст його з глибиною закономірно меншає.
Ж) – розчинність його у воді невелика і при звичайній температурі становить всього 3,1 см³ в 100 г води.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.6. У довіднику стосовно Флуору – фтору наводяться такі дані:
 А) – середній вміст в земній корі 6,25•10−2мас.%.
А) – середній вміст в земній корі 6,25•10−2мас.%.
Б) – у природі існує один стабільнийізотоп19F. Штучно отримані радіоактивні ізотопи з масовими числами 16, 17, 18, 20, 21, 22
В) – він настільки агресивний, що зіткнення з ним шкіри людини протягом 2 секунд призводить до появи опіку II ступеня, вода в атмосфері фтору горить синім полум'ям, а платина згорає як порох.
Г) –має унікальну здатність виявлятися по запаху при концентрації 0,02 мг/м³, яка в 7,5 раза нижче прийнятої гранично допустимої.
Ґ) –у промисловості фтор застосовується для виготовлення матеріалів, стійких до високих температур і впливу хімічно агресивних середовищ.
Д) –взаємодія з багатьма елементами, оксидами і солями, водою протікає дуже енергійно, а з воднем і вуглеводнями — часто з вибухом.
Е) –у перекладі з давньогрецької назва цього елемента означає "руйнування", "шкоду", "псування", "винищувати", "губити", "знищувати".
Є) –необхідний для міцності і твердості кісткової тканини, для формування сполучних тканин, особливо кісток, для росту і підтримки в здоровому стані зубів, волосся і нігтів, профілактики остеопорозу
Ж) – блідо-жовтий газ зі специфічним різким запахом, температурою плавлення–219,62оС.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
 4.7. У довіднику стосовно Натрію– натрію наводяться такі дані:
4.7. У довіднику стосовно Натрію– натрію наводяться такі дані:
А) – застосовують його яквідновник,теплоносій.
Б) – з водою реагує дуже бурхливо, навіть з вибухом, ще більш бурхливо реагує з кислотами (теж з вибухом).
В) – присутній у всіх внутрішніх органах, рідинах і тканинах організму людини, завдяки цьому мікроелементу стає можливим нормалізація балансу рідин. Кров, лімфа і травні соки містять йогоу вигляді різних солей.
Г) – у вільному стані — сріблясто-білий легкий і м'який метал, з густиною— 0,968 г/см3, температурою плавлення— 97,83°С, температурою кипіння —882,9 °С , коефіцієнтом твердості заМоосом 0,5.
Ґ) – вперше був отриманий англійським хіміком Гемфрі Деві в1807роціелектролізомтвердогоNaOH.
Д) –використовують при синтезі багатьох органічних речовин, для виготовлення деяких сплавів, а також у металургії для одержання ряду металів із їх сполук.
Е) –на нього припадає 2,64% масиземної кори. У зв'язку з високою хімічною активністю він зустрічається тільки у вигляді різнихсполук.
Є) –симптомами нестачі в організмі є: спрага; втрата апетиту і зниження ваги; сонливість і швидка стомлюваність; м’язові судоми; погіршення стану шкіри – зниження її еластичності; часті інфекційні захворювання .
Ж) – його зберігають під шаромгасуабо мінеральної оливи.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.8. У довіднику стосовно Магнію – магніюнаводяться такі дані:
 А) – особливе значення він має у функціонуванні нервової тканини і провідної системи серця,добра забезпеченість організму сприяє кращій протидії стресовій ситуації та депресії.
А) – особливе значення він має у функціонуванні нервової тканини і провідної системи серця,добра забезпеченість організму сприяє кращій протидії стресовій ситуації та депресії.
Б ) – легкий сріблясто-білий метал з температурою плавлення650 °С,температурою кипіння1095 С.
В) – протонне число 12, ІІ група головна підгрупа, відкритий Г. Деві у 1808 році.
Г) –розжарений метал енергійно взаємодіє з водою, тому його не можна гасити водою, добре горить і у вуглекислому газі.
Ґ) – ступінь окиснення +2, утворює металоорганічні сполуки.
Д) –основні мінерали:олівін, шпінель, тальк, карналіт, бішофіт, магнезит, кізерит, брусит, доломіт,каїніт.
Е) –його значення в життєдіяльності проявляється в тому, що він є універсальним регулятором біохімічних і фізіологічних процесів в організмі більш як у 300 хімічних реакціях
Є) –хімічно активний,на повітрі окиснюється й тьмяніє,при нагріванні горить яскравим полум'ям.
Ж) – застосовують в основному для виробництва легких магнієвих сплавів, також для легування сплавів алюмінію, для одержання важковідновлюваних металів (Ti, V, Zr, U, Cr) витісненням їх із сполук. Знаходить застосування впіротехніці,фотографії,військовій техніці,медицині.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
 4.9. У довіднику стосовно Алюмінію – алюмінію наводяться такі дані:
4.9. У довіднику стосовно Алюмінію – алюмінію наводяться такі дані:
А) – легкий, парамагнітний метал сріблясто-білого кольору, що легко піддається формуванню, литтю, механічній обробці.
Б) – одержують електролізом розчину глинозему (техн. Al2O3) в розплавленому кріоліті Na3[AlF6] при 950—960 °C.
В) – у 1855 р. на Всесвітній виставці у Парижі було представлено «срібло із глини», яке стало сенсацією.
Г) –належить до головної підгрупи третьої групи періодичної системи елементів, його порядковий номер — 13, на зовнішньому енергетичному рівні знаходиться три валентних електрони, тому в хімічних сполуках зазвичай трьохвалентий.
Ґ) – основні природні сполуки: нефеліни — (Na,K)2О • Аl2О3• 2SiО2, кріоліт — АlF3• 3NaF, боксити — алюмінієва руда Аl2O3• хH2O, каолін — Аl2О3• 2SiO2• 2Н2О, глиноземи — суміш каоліну з піском SiO2, вапняком СаСО3, магнезитом МgСО3.
Д) –за звичайних умов легко взаємодіє зкиснемповітряі вкривається тонкою (2·10−5см), але міцною оксидною плівкою Al2О3, яка захищає його від дальшого окиснення, обумовлюючи цим високу корозійну стійкість, надає йому матового вигляду і сіруватого кольору.
Е) –у наші дні його називають «крилатим металом». Він утричі легший від заліза й сталі надав міцності надшвидкісним літакам і штучним навколоземним супутникам.
Є) – в організмі людини вміст його – 10-3 %, виявлений в усіх органах і тканинах, найбільший вміст в легенях, печінці, кістках, головному мозку.впливає на центральну нервову систему (підвищений вміст в крові викликає її збудження, а понижений – гальмування).
Ж) – при 25°C реагує зхлором, бромом, йодом утворюючи відповідно хлорид AlCl3, бромід AlBr3, йодид AlI3, при 600 C —з фтором утворюючи фторид AlF3.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
 4.10. У довіднику стосовно Силіцію – кремніюнаводяться такі дані:
4.10. У довіднику стосовно Силіцію – кремніюнаводяться такі дані:
А) – електронна формула —14Si1s22s22p63s23p2;валентність — II (основний стан), IV (збуджений стан).
Б) – використовують як напівпровідник. З нього виготовляють так звані сонячні батареї, які перетворюють світлову енергію в електричну, також використовують у металургії для добування кремнистих сталей, які мають високу жаростійкість та кислототривкість.
В) – за поширеністю на Землі займає друге місце серед хімічних елементів (27,6% маси земної кори). У вільному стані в природі не зустрічається, протейого в значних кількостях отримують штучно для потреб промисловості.
Г) – він становить 27,6 % маси земної кори. У природі трапляється головним чином у вигляді силіцій (ІV)оксиду SiO2 та солей силікатних кислот — силікатів. Вони утворюють оболонку земної кори, його сполуки містяться в організмах рослин і тварин.
Ґ) – складається з трьох стабільних ізотопів:![]() (92,27 %),
(92,27 %),![]() (4,68 %) та
(4,68 %) та![]() (3,05 %); відкрито 20 радіоактивних ізотопів, серед яких найбільший період напіврозпаду 170 років має ізотоп32Si, 31Si має період напіврозпаду 157,3 хвилини. Усі інші радіоактивні ізотопи живуть менше, ніж сім секунд, а більшість із них менше, ніж одну десяту секунди.
(3,05 %); відкрито 20 радіоактивних ізотопів, серед яких найбільший період напіврозпаду 170 років має ізотоп32Si, 31Si має період напіврозпаду 157,3 хвилини. Усі інші радіоактивні ізотопи живуть менше, ніж сім секунд, а більшість із них менше, ніж одну десяту секунди.
Д) –у промисловості його добувають відновленням SiO2 коксом в електричних печах:SiO2 + 2С = Si + 2СO.
Е) –утворює темно-сірі зі смолистим блиском крихкікристали з густиною 2,328г/см3, tплав = 1415°C, tкип = 3250°C, твердістьза шкалоюМооса 7.
Є) –з нього добувають карборунд, завдяки великій твердості (9-9,5 за шкалою Мооса) його використовують як абразивний матеріал, у виробництві композитних матеріалів, ювелірних виробів тощо.
Ж) – за звичайних умов досить інертний. Безпосередньо він взаємодіє тільки із фтором: Si + 2F2 = SiF4.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
 4.11. У довіднику стосовно Фосфору – фосфору наводяться такі дані:
4.11. У довіднику стосовно Фосфору – фосфору наводяться такі дані:
А) – знаходиться в головній підгрупі п'ятої групи третього періоду Періодичної системи;
атомний номер15; атомна маса 30,97376.
Б ) – білий фосфор (в дійсності, внаслідок наявності домішок має жовтуватий відтінок і тому називається також жовтим фосфором) легко самозаймається, світиться у темряві, дуже отруйний, викликає сильні опіки.
В) – хронічне отруєння білим фосфором може призвести до виродження жирової тканини та загнивання нижньої щелепи. При потраплянні на шкіру чи в очі негайно промивають 5-%вим розчиномCuSO4·5H2Oі накладають пов'язку просочену цим же розчином. Цим же розчином гасять білий фосфор, при цьому він вкривається металевою міддю, що ізолює його від доступу повітря.
Г) – у практиці застосовується переважно червоний фосфор, головним чином у сірниковому виробництві. В суміші з товченим склом і клеєм його наносять на бічні поверхні сірникових коробок.
Ґ) – у природі відомий один стабільний ізотоп —31Р. Утворює близько 190 мінералів, найважливішими з яких є апатитCa5(PO4)3(F, Cl, OH),фосфорит та інші.
Д) – близько половини світових запасів знаходиться на Близькому Сході
Е) –життєво необхідний для нормального функціонування організму, а саме нирок, печінки, серця і мозку,необхідний для здоров'я внутрішніх органів, суглобів ізубів.
Є) –легко окиснюється киснем повітря до оксидів, галогенами— до галогенідів, при сплавленні з сіркою утворює сульфіди, а при нагріванні з металами— фосфіди.
Ж) – відкритий гамбурзьким алхіміком Геннігом Брандому 1669році. Він намагався відшукати еліксир життя або філософський камінь, а отримав речовину, що світилася в темряві, названу спочатку «холодним вогнем», а пізніше фосфором, від грец.φως-φορος — світлоносний. Цим відкриттям Бранд не збагатився і продав спосіб отриманняДаніелю Крафту, який заробив на цьому статок.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.12. У довіднику стосовно Сульфуру – сульфуру наводяться такі дані:
А) – порівняно легко реагує з киснем; якщо її підпалити – горить на повітрі з утворенням сульфур діоксиду SO2 (сульфітного ангідриду) і в дуже незначній кількості сульфур триоксиду SO3(сульфатного ангідриду).
Б) – у Стародавньому Китаї її стали використовувати як компонент пороху і піротехнічних сумішей.
 В) – в природі вона зустрічається як у вільному стані— так званасамородна _ _ _, але значно частіше зустрічається в зв'язаному вигляді, тобто у вигляді різних сполук. Найважливіші з них—залізний колчедан, або пірит FeS2, цинкова обманка ZnS, свинцевий блиск PbS, мідний блиск Cu2S,гіпс CaSO4 2H2O, мірабіліт Na2SO4 10H2O тощо.
В) – в природі вона зустрічається як у вільному стані— так званасамородна _ _ _, але значно частіше зустрічається в зв'язаному вигляді, тобто у вигляді різних сполук. Найважливіші з них—залізний колчедан, або пірит FeS2, цинкова обманка ZnS, свинцевий блиск PbS, мідний блиск Cu2S,гіпс CaSO4 2H2O, мірабіліт Na2SO4 10H2O тощо.
Г) – найбільше міститься в наступних продуктах харчування: яйця, телятина, молоко, сир, риба і морепродукти, капуста, бобові (квасоля, горох).
Ґ) – може безпосередньо реагувати майже з усіма металами (за винятком благородних), але переважно при нагріванні.
 Д) – відомі кілька алотропних форм а — кристалічної, б — пластичної; її кристалів: в — ромбічної, г — моноклінної; за звичайних умов стабільною є ромбічна форма— блідо-жовтого кольору, з густиною 2070 кг/м3, tплав= 112,8оС, tкип= 444,6оС. У всіх рідких і твердих станах —діамагнітна.
Д) – відомі кілька алотропних форм а — кристалічної, б — пластичної; її кристалів: в — ромбічної, г — моноклінної; за звичайних умов стабільною є ромбічна форма— блідо-жовтого кольору, з густиною 2070 кг/м3, tплав= 112,8оС, tкип= 444,6оС. У всіх рідких і твердих станах —діамагнітна.
Е) –за стандартних умов —нерозчинна у воді й важча за неї. Проте її порошок у воді не тоне, залишаючись на поверхні, оскільки не змочується водою. Якщо додати до води незначну кількість спирту або ацетону, вонаосідає на дно. Але добре розчиняється в сірковуглеці, бензині та інших органічних розчинниках.
Є) – досить багато її міститься в поверхневих шарах шкіри; входить до складу меланіну, що надає нашій шкірі загорілого вигляду, він же "забарвлює" родимки в бурий колір; є складовою кератину, що є основою нігтів і волосся. Є компонентом таких гормонів, як інсулін, кальцитонін та інших.
Ж) – застосовують переважно у хімічній промисловості для виробництва сульфатної кислоти, синтетичного волокна, сірчистих барвників, димного пороху, у ґумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.13. У довіднику стосовно Хлору – хлору наводяться такі дані:
А) – він дуже широко застосовується у техніці, а саме у виробництві хлорорганічних сполук, які використовують для боротьби з шкідниками і бур'янами в сільському господарстві, барвників, лікарських та інших речовин, для вибілювання тканини, паперу, дезінфекції тощо.
Б) – у лабораторії його добувають взаємодією концентрованої хлоридної кислоти з сильними окисниками. Основним промисловим способом одержання хлору є електроліз розплаву або концентрованого розчину натрій хлориду. Збирають його витісненням повітря у посудину дном донизу .
.
В) – уперше добув шведський хімік К. Шеєле (1774).
Г) – складається з двохатомних молекул, які у твердому стані утворюють молекулярну кристалічну ґратку.
Ґ) – використовується як дезінфікуючий засіб, особливо уплавальних басейнахта у шкільних закладах.
Д) –у природі існує два стабільних ізотопи:35Cl i37Cl. Входить у групу галогенів (дослівно «галоген» перекладається як солерід).
Е) – знаходиться в головній підгрупі VII групи з атомним номером 17
Є) –за стандартних умов – це отруйний газ зеленкувато-жовтого кольору, з різким запахом, помірно розчиняється у воді, важчий за повітря, має низькі температури плавлення і кипіння. При вдиханні дуже подразнює слизову оболонку і викликає гострий кашель, а у великих кількостях— навіть смерть.
Ж) – хімічно дуже активний. Окиснювач. Утворює сполуки майже з усіма хімічними елементами.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.14. У довіднику стосовно Калію – калію наводяться такі дані:
А) – 1807року англійський хімік Гемфрі Деві електролізом твердого їдкого калію (KOH) виділив калій і назвав його потассієм.1809року Людвіг Вільгельм Гільберт запропонував назву «калій» (від араб. аль-калі—поташ).
 Б) – міститься в багатьох продуктах харчування, але особливо багаті їм: м'ясо; гриби; соя; гречана, вівсяна, пшенична крупа; картопля; томати; сухофрукти; зелений чай, какао.
Б) – міститься в багатьох продуктах харчування, але особливо багаті їм: м'ясо; гриби; соя; гречана, вівсяна, пшенична крупа; картопля; томати; сухофрукти; зелений чай, какао.
В) – належить до головної підгрупи першої групи періодичної системи Д.І. Менделєєва, його атоми мають на зовнішньому електронному шарі по одному електрону, який вони легко втрачають і перетворюються в йони з одним позитивним зарядом,тому в своїх сполуках буває лише позитивно одновалентним.
Г) – належить до групи лужних металів, символ К, атомний номер19;атомна маса 39, 098.
Ґ) – його сполуки застосовують усільському господарстві якдобрива, для виготовлення скла,вибухових речовин, у медицині,ядерній техніці тощо.
Д) –його дефіцит призводить до ризику розвитку серцевої недостатності, інсульту, небезпечних для життя аритмій, порушення серцевого ритму.
Е) –у вільному стані — м'який сріблясто-білий легкий метал, легко ріжеться ножем, з густиною — 0,856 г/см3, температурою плавлення— 63,38°С, температурою кипіння760°C. Хімічно дуже активний, сильний відновник, на повітрі легко окиснюється.
Є) –з водою реагує дуже бурхливо, навіть з вибухом. Ще більш бурхливо реагує з кислотами (теж з вибухом). У вологому повітрі метал легко перетворюються в гідроксид:2K + 2H2O = 2KOH + H2↑
Ж) – найбагатші у світі родовища солей: у вигляді мінералів сильвіну KCl, сильвініту KCl·NaCl, карналіту KCl·MgCl2·6H2O і каїніту KCl·MgSO4·3H2Oзначні поклади сполук його знайдені в Україні (м.Калуші м.Стебнику Прикарпатті).
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні?
4.15. У довіднику стосовно Кальцію – кальцію наводяться такі дані:
А) – входитьдо складу вапняку, крейди, гіпсу, апатиту тощо, які належать до поширених мінералів.
Б) – добре проводить електричний струм.
В) – має валентність ІІ.
Г) – в організмі людини міститься в середньому близько 1г.
Ґ) –розчиняється в рідкому амоніаку з утворенням електропровідних розчинів.
Д) – реагує з водою майже з такою самою швидкістю, як і літій.
Е) – це сріблястий метал з температурою плавлення 8500С.
це сріблястий метал з температурою плавлення 8500С.
Є) – за поширеністю в земній корі займає V місце (4,1% за масою).
Ж) –уперше був отриманий Г. Деві в 1808р. під час електролізу суміші гашеного вапна із меркурій(ІІ) оксидом.
У яких твердженнях ідеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, які – хімічні, а які – добування ?
4.16. У довіднику стосовно Феруму – заліза наводяться такі дані:
А) – сріблясто-білий блискучий метал з температурою плавлення 1535 ºС і густиною 7,87 г/см3. Від інших металів відрізняється магнітними властивостями, воно є дуже пластичним металом і легко піддається обробці.
Б) – складається з чотирьох природних стабільних ізотопів: 54Fe (ізотопна поширеність 5,845%), 56Fe (91,754%), 57Fe (2,119%) і 58Fe (0,282%). Також відомо понад 20 нестабільних ізотопів заліза з масовими числами від 45 до 72, найстійкіші з яких — 60Fe (період напіврозпаду за уточненими в 2009 році даними становить 2,6 мільйона років), 55Fe (2,737 року), 59Fe (44,495 доби) і 52Fe (8,275 години); інші ізотопи мають період напіврозпаду менше 10 хвилин.
В) – нестача його в організмі може призводити до анемії.
Г) – у своїх сполуках здатен проявляти ступені окиснення +2, +3 та +6.
Ґ) – знаходиться в побічній підгрупі VІІІ групи 4 періоду Періодичної системи хімічних елементів. Він є представником d-елементів. На зовнішньому енергетичному рівні атома _ _ _ знаходиться два s-електрони, а на передзовнішньому енергетичному рівні відбувається заповнення d-підрівня.
Д) – реагує з неметалами — киснем, галогенами, сіркою, вуглецем, водяною парою, з розчинами кислот.
 Е) – найважливіший метал сучасної техніки. Його сплави широко застосовують як конструкційні та художні матеріали.
Е) – найважливіший метал сучасної техніки. Його сплави широко застосовують як конструкційні та художні матеріали.
Є) – він займає четверте місце по розповсюдженості в природі. Найважливішими залізними рудами є: магнетит Fе3О4, гематит Fe2О3, лімоніт — Fe2O3·nH2O, сидерит FеСО3, пірит FеS2.
Ж) – належить до металів середньої активності. Хімічно чисте – стійке до корозії, однак незначні частки домішок позбавляють його цієї властивості.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні ?
 4.17. У довіднику стосовно Купруму –міді наводяться такі дані:
4.17. У довіднику стосовно Купруму –міді наводяться такі дані:
А) – алхіміки називали її — «венера» (Venus)
Б) – це пластичний ковкий перехідний метал червонувато-золотистого кольору (рожевий за відсутності оксидної плівки), добрий провідник тепла і електрики. Віддавна широко вживаний людиною.
В) – у монетній справі з часів античності мідь використовувалась у складі сплавів (лігатур). Сучасне широке застосування її пов'язане з високою електропровідністю, хімічною стійкістю, пластичністю і здатністю утворювати сплави з багатьма металами: оловом (бронза), цинком (латунь), нікелем (мельхіор) і ін., Вона використовується в різних галузях промисловості: електротехнічній (50%), машинобудуванні (25%), будівельній, харчовій і хімічній (25%) галузях.
Г) – відома з глибокої давнини, з античних часів служила для чеканення монет і медалей.
Ґ) – малоактивний метал, в електрохімічному ряду напруг стоїть правіше за водень; не взаємодіє з водою, розчинами лугів, хлоридною і розведеною сульфатною кислотою. Проте в кислотах — сильних окислювачах (наприклад, у нітратній і концентрованій сульфатній) — розчиняється.
Д) – цей метал згубно діє на бактерії, віруси і грибки, такі як золотистий стафілокок, аденовіруси, кишкова паличка, кандида, лістерія, сальмонела і т.д. Вважається, що на поверхні чистої протимікробної _ _ _ подібні шкідники гинуть за 2 години.
 Е) Більша її половина, що добувається, використовується в електротехніці для виготовлення різних проводів, кабелів, струмопровідних частин електротехнічної апаратури.
Е) Більша її половина, що добувається, використовується в електротехніці для виготовлення різних проводів, кабелів, струмопровідних частин електротехнічної апаратури.
Є) – відносять до d-елементів, а валентні електрони розміщені на 3d- та 4s-підрівнях, тому у сполуках проявляє ступені окиснення +1 та +2.
Ж) – для організму людини відіграє важливу роль у відновленні нормальних показників крові, в побудові сполучних тканин, регуляції ендокринних, і окиснювально-відновних процесів.
У яких твердженнях йдеться про просту речовину, а в яких – про хімічний елемент? Які твердження характеризують фізичні властивості простої речовини, а які – хімічні ?
ЛІТЕРАТУРА
-
Буринська Н.М., Депутат В.М., Сударева Г.Ф., Чайченко Н.Н. Хімія:
Підручник для 10 кл. загальноосвіт. навч. закл. (профільн. рівень). — К.: Педагогічна думка, 2010. — 352 с.: іл., табл. - Локшина О.І. Моніторинг рівнів досягнень компетентностей: інноваційні підходи / О.І. Локшина // Компетентнісний підхід у сучасній освіті: світовий досвід та українські перспективи: Бібліотека з освіт- ньої політики / за заг. ред. О.В. Овчарук. – К. : К.І.С., 2004. – С. 25–32.
- Пигуль В.С. Хімічні елементи в організмі людини. – Х.: Вид. група «Основа», 2004. – 96 с. ‒ (Серія «Бібліотека журналу «Хімія»;Вип..3(15)).
- Сорока Л.В. Хімя. Екологічні задачі. – Тернопіль: Мандрівець, 2003. – 80с.
- Глинка Н. Л. Общая химия. – Л:Химия, 1988. – 702с.
- Романова Н. В. Загальна та неорганічна хімія: Підручник для студ. вищ. навч. закл. – К.; Ірпінь: ВТФ Перун, 2002. – 480с.
- Цветкова Л. Б. Загальна хімія:теорія і задачі: Навчальний посібник. Ч.І. – Львів: «Магнолія-2006», 2007. – 398с.
- Василега М. Д. Цікава хімія - 2вид., перероб.і допов. – К.: Рад. шк., 1989. – 188с.
- Євсеєв Р. С. Усі цікаві досліди. Хімія. 10–11 класи – Х.: ТОРСІНГ ПЛЮС. 2006. – 320с.
- Біологічна хімія. Практикум: Навчальний посібник. – К.: Вища школа, 1977. – 384с.
- Боєчко С. М. Біологічна хімія. – К.: Наукова думка,1995. – 353с.
- Вредные химические вещества. Углеводороды. Галогенопроизводные углеводородов: Справочник /А.Л. Бандман, Г. А. Войтенко, Н.В. Волкова и др. – Под ред. В. А . Филатова. – Л.: Химия, 1990. – 732с.
- Соловьев Ю. И. История химии. Развитие химии с древнейших времен до конца Х ІХ века: Пособие для учителей. – М.: Просвещение, 1976. – 367с.
- Малахова Н.М. Пізнавальні завдання з хімії 7 -9 класи –Харків «Основа», 2011–126 с.
- Веремієва Л.А. З досвіду роботи над проблемою «Формування соціальних компетентностей на уроках хімії» /Веремієва Л. А./ -2009 -No 19 –с. 2 –4
- http://www.chemistry.in.ua/
- http://cikavi-fakty.com.ua/cikavi-fakti-pro-ximiyu/
- https://uk.wikipedia.org/wiki/
- dovidka.biz.ua/tsikavi-fakti-z-nazv-himichnih-elementiv/
- cikavahimiya.blogspot.com/2016/02/blog-post_24.html
- chem224.blogspot.com/p/blog-page.html
1


про публікацію авторської розробки
Додати розробку
