Урок. Презентація до уроку. "Білки як високомолекулярні сполуки. Хімічні властивості білків
ТЕМА: БІЛКИ ЯК ВИСОКОМОЛЕКУЛЯРНІ СПОЛУКИ.
ХІМІЧНІ ВЛАСТИВОСТІ БІЛКІВ
Цілі: формування ключових компетентностей:
спілкування державною мовою; уміння вчитися впродовж життя; інформаційно-цифрова; екологічна грамотність і здорове життя; соціальна та громадянська компетентності; формування ключових природничих компетентностей на основі ознайомлення кадетів з білками як найвищим ступенем розвитку речовин у природі, структурою, властивостями , функціями які зумовили появу життя;
формування предметних компетентностей:
виховувати вміння виділяти головне, актуалізувати, конспектувати, порівнювати, зіставляти; розвивати хімічну мову, екологічне мислення; виховувати інтерес до вивчення хімії.
Обладнання: мультимедійна презентація, ППЗ «Віртуальна хімічна лабораторія».
Тип уроку: ( вивчення нового матеріалу )формування компетентностей
Форми роботи: лекція, бесіда, розповідь учителя, робота в парах, складання схем, доповіді учнів, м'яке опитування, лабораторні досліди 3, 4; навчальні проекти.
ХІД УРОКУ
І. Організаційний
ІІ. Актуалізація знань
Хімічний диктант «Так чи ні»
1. Амінокислоти містять групу –NH2. (Так)
2. Молекули амінокислот містять три функціональні групи. (Ні)
3. Амінооцтова кислота(гліцин)-найпростіша амінокислота. (Так)
4. Амінокислоти мають кислотні властивості. (Ні)
5. Амінокислоти є амфотерними сполуками. (Так)
6. У природі існують родовища амінокислот. (Ні)
7. Індикатор у розчинах амінокислот виявляє нейтральну реакцію. (Так)
8. У результаті реакції поліконденсації амінокислоти утворюють пептиди. (Так)
9. Пептидний зв’язок утворюється між карбоксильною групою однієї кислоти і аміногрупою іншої кислоти. (Так)
10. В розчинах амінокислот утворюється біполярний іон. (Так)
11. Амінокислоти містяться тільки в людському організмі .(Ні)
ІІІ. Визначення теми уроку та його завдань.
На слайд 2: шерсть,пір’я, м’ясо, риба, мізим, яйця.
Проблемне питання: Що об’єднує ці предмети? Яка речовина входить до вмісту кожного з них. Це білки. Вони є темою сьогодняшнього уроку. Отже, цілі уроку: вивчити особливості будови білків, їх властивості, розширити і поглибити знання про функції білків у живих організмах.
ІV. Мотивація.
" Життя є спосіб існування білкових тіл , істотним моментом якого є постійний обмін речовин з навколишнім їх зовнішньою природою , причому з припиненням цього обміну речовин припиняється і саме життя , що призводить до розкладання білка " . ( Ф.Енгельс ) .
Яке ще визначення життя вам знайоме ?
Сучасна наука являє життя як переплетення найскладніших хімічних процесів взаємодії білків між собою та іншими речовинами. Серед усіх речовин органічної природи білки займають особливе місце — вони становлять основу структури всіх живих систем і виконують ряд важливих функцій.
V. Первинне засвоєння.
Вперше білок був виділений (у вигляді клейковини) в 1728 р. італійцем Якопо Бартоломео Беккаріа (1682 - 1766) з пшеничного борошна. Цю подію прийнято вважати народженням хімії білка.
Горбачевський Іван Якович - Один з перших вказав, що амінокислоти є складовими білків. У 1898 році його наукова діяльність була відмічеа найвищою нагородою Австро-Угорщини – Орден Залізної корони.
Эмиль Герман Фишер - У 1902 р. сформулював пептидну гіпотезу, згідно з якою білки побудовані з амінокислотних залишків, з'єднаних пептидними зв'язками .
Ла́йнус Карл По́линг - Сформулював концепцію вторинної структури білка.
Якщо люба жива істота складається з молекул білків, то де синтезуються білки? (Молекули білків утворюються у клітині організму з 20 α-амінокислот, Їх ще називають золотими). Вісім із амінокислот (триптофан, лейцин, ізолейцин, лізин, метіонін, фенілаланін, треоніт, валін) належать до незамінних – їх людина одержує з їжею, тому що організмом вони не синтезуються.
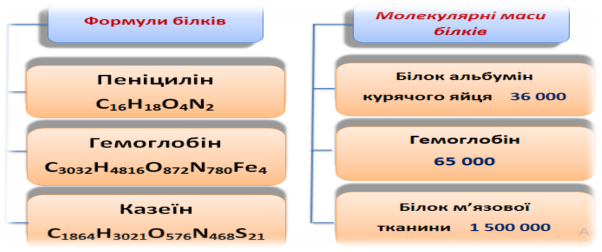
Білки- це складні високомолекулярні природні сполуки, побудовані із залишків α-амінокислот, з’єднаних у певній послідовності пептидним зв’язком.
Білки можна розглядати як поліпептиди (дипептиди, трипептиди, …), тому що їх молекулярна маса більша за 10000.
До елементарного складу білків входять 5 основних елементів:
Карбон (С) – 50 – 55%
Гідроген (Н) – 6,5 – 7,3%
Оксиген (О) - 21,5 – 23,5%
Нітроген (N) – 15 – 17%
Сульфур (S) – 0,3 – 2,5%
Фосфор (Р), Йод (І), Ферум (Fe), інші елементи – у невеликій кількості.
Який елемент є основою білків? (Карбон). Це говорить про належність до сполук мінерального чи органічного походження? (Органічного)
Структури білка:
Первинна – хімічна структура білка, тобто послідовність чергування амінокислотних залишків у поліпептидному ланцюгу даного білка. Зв’язок – пептидний.
Вторинна – форма поліпептидного ланцюга в просторі. Вона може бути ниткоподібною, спіралеподібною та ін. форми. Зв’язок – пептидний і водневий між групами -СО- та -NH, розташованих на різних витках спіралі.
Третинна – реальна тривимірна конфігурація, утворена складанням вторинних структур (одна глобула). Зв’язок – додатковий водневий зв`язкам, ковалентним дисульфід ним зв`язкам( «місток») -S-S-, та сольовий місток між –СОО- ……NH3 + . Третинну структуру можна уявити собі як спіраль, яка згорнута , у свою чергу спіраллю!!!
Четвертинна – поєднання в просторі кількох макромолекул (кілька глобул). Зв’язок _ між глобулами виникають нові дисульфідні і сольові містки, а також водневі. Глобулярні білки – білки, які мають форму клубка.
Хімічні властивості білків
1. Гідроліз білків
При нагріванні з розчинами кислот чи лугів або під впливом ферментів
Білок + пН2О → суміш α-амінокислот
2. Денатурація
– руйнування вторинної і третинної структури білка під дією нагрівання, радіації, сильних кислот, лугів, спиртів, сильного струшування.
Пригадайте приготування яєчні, смаження риби, м яса. Це приклади денатурації.
3. Кольорові реакції на білок:
Біуретова реакція – яка є якісною на пептидний з’вязок
Готуємо осад Купрум (ІІ) гідроксид: до розчину Калій гідроксиду додаємо кілька крапель розчину купрум (ІІ) сульфату
КОН + СuSO4 → Cu(OH)2↓ + K2SO4 (блакитний осад)
До розчину білка додаємо кілька крапель купрум (ІІ) гідроксиду і спостерігаємо характерне фіолетове забарвлення.
Ксантопротеїнова реакція – яка є якісною на ароматичні залишки
Внаслідок дії на білок концентрованої нітратної кислоти виникає жовте забарвлення, яке при додаванні лугу змінюється на оранжеве. Ця реація доводить що білок містить у своєму складі бензольне кільце.
Функції білків:
(Робота з додатковими джерелами) - Самостійна робота
Прочитайте текст і заповніть таблицю «Функції білків». Поясніть, чому білки мають пріоритетне значення для життя?
|
Функції |
Зміст |
Приклади |
|
1Структурна (будівельна) |
Будівельний матеріал (ніби із цеглинок складаються організми) |
Кератин, колаген, мембранні білки |
|
2. Сигнальна |
Повідомляє про порушення умов; сприймають і передають сигнали що надходять від сусідних клитин |
Клітинні рецептори, родопсин. |
|
3. Рухова |
Скорочення |
Мускулатура, органи руху найпростіших; міозін, актин |
|
4. Транспортна |
Перенесення біомолекул, О2 та СО2 |
Гемоглобін |
|
5. Захисна |
Здійснюють імунний захист (знешкоджують чужорідні речовини) |
імуноглобулін, антитіла |
|
6. Енергетична |
Постачають енергію в організм |
1г білка – 17,6 кДж |
|
7. Каталітична (ферментативна) |
Прискорення реакцій |
всі ферменти є за своєю природою білками - рибонуклеаза |
|
8. Регуляторна |
Регулюють обмінні процеси |
Гармони, модулятори, інсулін |
VІ. Узагальнення та систематизація знань.
Висновок: Біологічна роль амінокислот та білків
- Амінокислоти – це будівельний матеріал для білків.
- Знання властивостей білків допомагає зберегти життя людям: у разі отруєння солями важких металів вживають молоко, білки якого зв’язують ці сполуки.
- Білки їжі не засвоюються організмом, спочатку вони розщеплюються до амінокислот, а потім амінокислоти всмоктуються в кров, а вже з нею переносяться до клітин, де організм синтезує білки.
- Організм людини не здатний синтезувати амінокислоти тому для поповнення їх запасу потрібно вживати білкову їжу.
VІІ. Контроль і корекція знань.
1. Вегетаріанці проти м'ясоїдів: що корисніше для здоров'я?
Шкідливо чи корисно їсти м’ясо?
2. Чому лікарі рекомендують «збивати» температуру хворого, якщо вона перевищує 38о С? (можлива денатурація білка)
3. Чому з вареного яйця ніколи не з’явиться курча? (Білок яйця незворотно втрачає структуру з-за тепловий денатурації)
4. Чому на упаковці прального порошку з ензимами стоїть обмеження по температурі для прання 40о С ? (ензими – це ферменти білкового походження, які при температурі більш 40о С втрачають свої властивості, відбувається денатурація.)
5. Чому не можна сушити шкіряне взуття притуливши до батареї?
6. Навіщо маринують м’ясо для шашлику?
7. На чому базується використання спирту як дезинфікуючого засобу? (Викликає денатурацію білків бактерій).
VІІІ. Підведення підсумків, оцінювання знань.
ІХ. Домашнє завдання.
Опрацювати зміст §29 вправа 220,222 с.176
Підготувати реферати на тему:
- Білкова їжа в раціоні людини.
- Методи синтезу білків.
- Значення синтетичних білків.
- Роль білків і амінокислот в житті людини.
|
Функції |
Зміст |
Приклади |
|
1. |
Будівельний матеріал (ніби із цеглинок складаються організми) |
Кератин, колаген, мембранні білки |
|
2. |
Повідомляє про порушення умов; сприймають і передають сигнали що надходять від сусідних клитин |
Клітинні рецептори, родопсин. |
|
3. |
Скорочення |
Мускулатура, органи руху найпростіших; міозін, актин |
|
4. |
Перенесення біомолекул, О2 та СО2 |
Гемоглобін |
|
5. |
Здійснюють імунний захист (знешкоджують чужорідні речовини) |
імуноглобулін, антитіла |
|
6. |
Постачають енергію в організм |
1г білка – 17,6 кДж |
|
7. |
Прискорення реакцій |
всі ферменти є за своєю природою білками - рибонуклеаза |
|
8. |
Регулюють обмінні процеси |
Гармони, модулятори, інсулін
|
|
Функції |
Зміст |
Приклади |
|
1. |
Будівельний матеріал (ніби із цеглинок складаються організми) |
Кератин, колаген, мембранні білки |
|
2. |
Повідомляє про порушення умов; сприймають і передають сигнали що надходять від сусідних клитин |
Клітинні рецептори, родопсин. |
|
3. |
Скорочення |
Мускулатура, органи руху найпростіших; міозін, актин |
|
4. |
Перенесення біомолекул, О2 та СО2 |
Гемоглобін |
|
5. |
Здійснюють імунний захист (знешкоджують чужорідні речовини) |
імуноглобулін, антитіла |
|
6. |
Постачають енергію в організм |
1г білка – 17,6 кДж |
|
7.
|
Прискорення реакцій |
всі ферменти є за своєю природою білками - рибонуклеаза |
|
8. |
Регулюють обмінні процеси |
Гармони, модулятори, інсулін
|


про публікацію авторської розробки
Додати розробку
