Презентація «Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій». 8 клас
Про матеріал
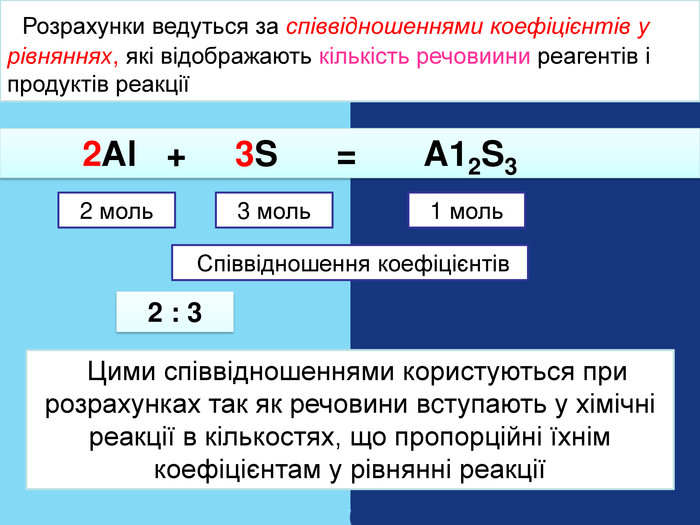
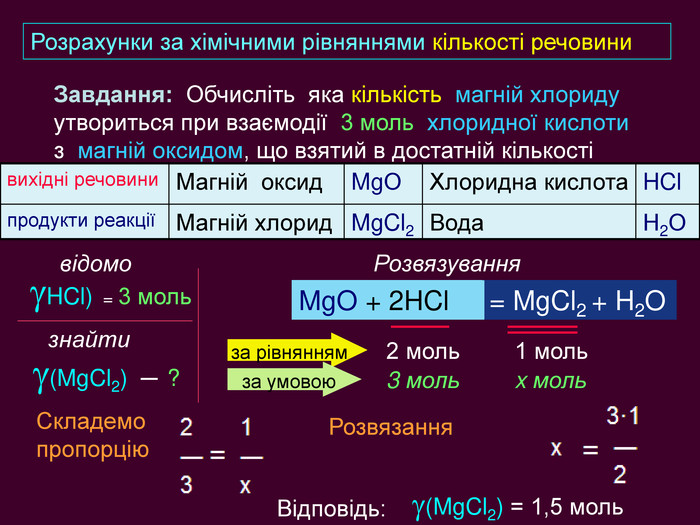
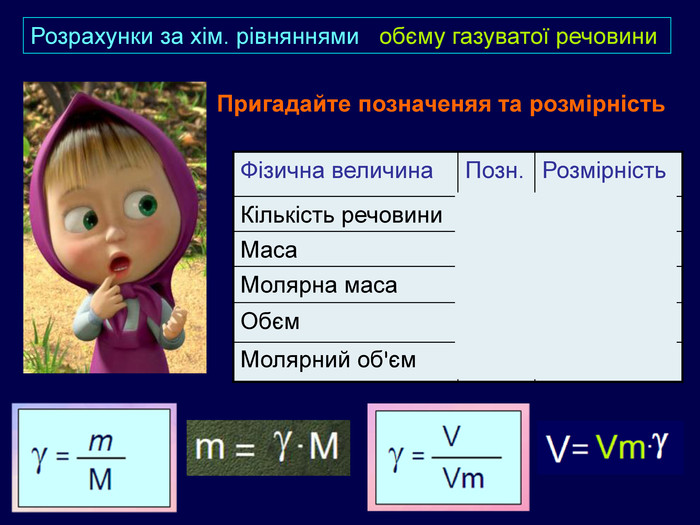
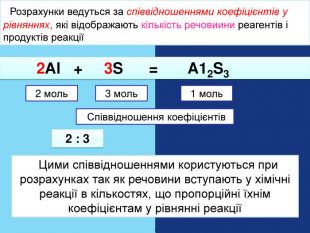
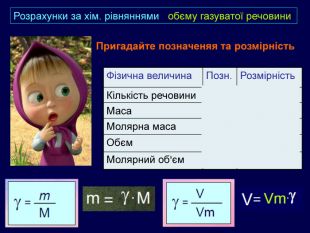
| Презентація допоможе в Розрахункові задачі №10: «Розрахунки за хімічними рівняннями маси, об'єму, кількості речовини реагентів та продуктів реакцій.» |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






























-

Юсин Надія Улянівна
10.04.2024 в 19:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Остаповець Юрій
10.01.2024 в 18:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Безсонова Оксана
19.04.2023 в 16:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
09.05.2022 в 18:41
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Казімко Ольга Сергіївна
05.04.2022 в 15:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
15.03.2022 в 20:48
ДЯКУЮ
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
09.03.2022 в 14:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Труфаненко Володимир
02.02.2022 в 20:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
26.04.2021 в 18:40
Просто обожнюю Ваши презентації. Ви - молодчина!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Савчук Ірина Миколаївна
08.03.2021 в 22:04
Усі презентації складені чудово, вже не вперше ними користуюсь. Щиро дякую!!! Матеріал підібрано змістовно, логічно, яскраво оформлено і підкріплено неймовірними, як на мій погляд, спецефектами. Працюйте, створюйте, надихайте!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Безручко Олена Анатоліївна
05.03.2018 в 13:47
Загальна:
4.7
Структурованість
4.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 8 відгуків