Презентація "Повторення за 8 клас"
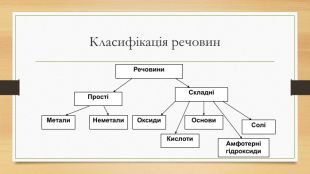
Повторення з теми "склад і властивості основних класів неорганічних сполук"

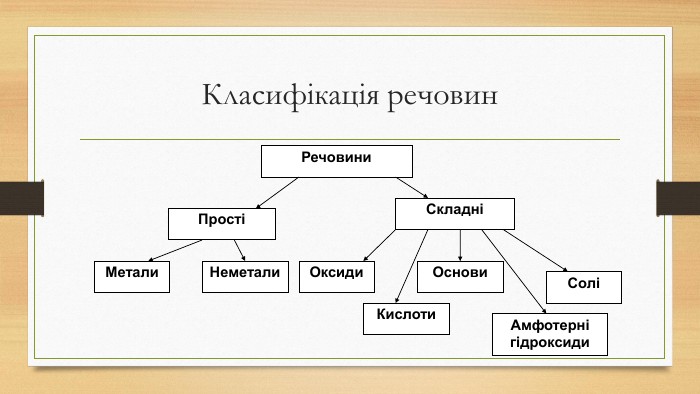






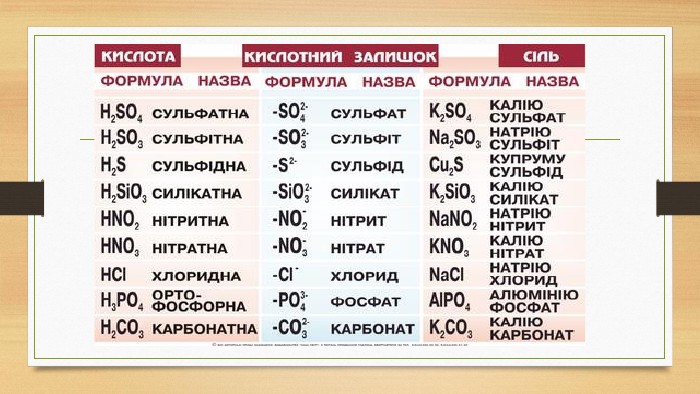















Пригадайте поняття. Група №1. Основні оксиди, їх будова властивості, добування. Група №2. Кислотні оксиди, їх будова властивості, добування. Група №3. Кислоти, їх будова властивості, добування. Група №4. Основи, їх будова властивості, добування. Група №5. Амфотерні сполуки, їх будова властивості, добування. Група №6. Солі, їх будова властивості, добування.
Хімічні властивості основних оксидів1. Взаємодія основних оксидів лужних та лужноземельних елемтів з водою ( інші оксиди металічних елементів з водою не взаємодіють): Основний оксид + Н2 О => основа (Ме(ОН)n)Ва. О + Н2 О = Ва(ОН)2 – Барій гідроксид. К2 О + Н2 О = 2 КОН – Калій гідроксид. АІ2 О3 + Н2 О =/
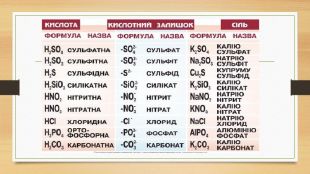
Хімічні властивості кислотних оксидів1. При взаємодії кислотних оксидів з водою утворюються кислоти: Кислотний оксид + Н2 О = > Кислота ( Нх. КЗ) Р2 О5 + 3 Н2 О = 2 Н3 РО4 – ортофосфатна кислота. SO2 – H2 SO3 N2 O5 – HNO3 Si. O2 – H2 Si. O3 SO3 - H2 SO4 CO2 – H2 CO3 (Si. O2 – не реагує з водою)N2 O3 – HNO2 P2 O5 – Н3 РО4 P2 O3 – НРО3
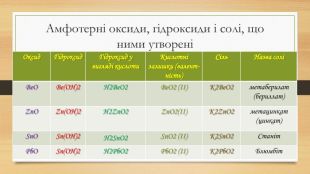
Амфотерні оксиди, гідроксиди і солі, що ними утворені{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Оксид Гідроксид Гідроксид у вигляді кислоти. Кислотні залишки (валент-ність)Сіль Назва соліBe. OBe(OH)2 H2 Be. O2 Be. O2 (ІІ)K2 Be. O2метаберилат (бериллат)Zn. OZn(OH)2 H2 Zn. O2 Zn. O2(ІІ)K2 Zn. O2метацинкат (цинкат)Sn. OSn(OH)2 H2 Sn. O2 Sn. O2 (ІІ)K2 Sn. O2 Станіт. Pb. OSn(OH)2 H2 Pb. O2 Pb. O2 (ІІ)K2 Pb. O2 Блюмбіт
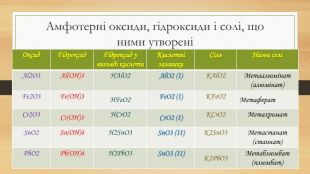
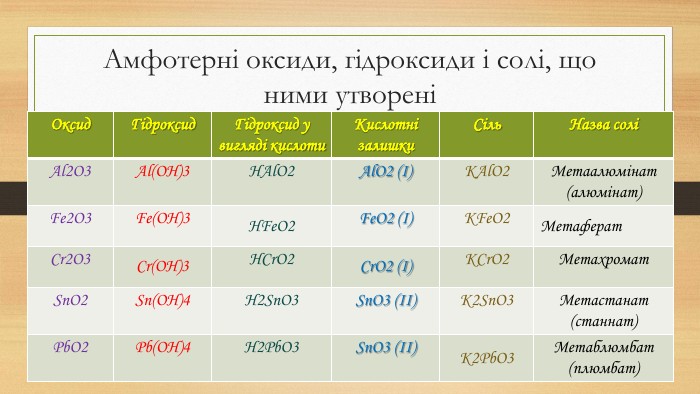
Амфотерні оксиди, гідроксиди і солі, що ними утворені{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Оксид Гідроксид Гідроксид у вигляді кислоти. Кислотні залишки. Сіль Назва соліAl2 O3 Al(OH)3 HAl. O2 Al. O2 (І)KAl. O2 Метаалюмінат (алюмінат)Fe2 O3 Fe(OH)3 HFe. O2 Fe. O2 (І)KFe. O2 Метаферат. Cr2 O3 Cr(OH)3 HCr. O2 Cr. O2 (І)KCr. O2 Метахромат. Sn. O2 Sn(OH)4 H2 Sn. O3 Sn. O3 (ІІ)K2 Sn. O3 Метастанат (станнат)Pb. O2 Pb(OH)4 H2 Pb. O3 Sn. O3 (ІІ)K2 Pb. O3 Метаблюмбат (плюмбат)


про публікацію авторської розробки
Додати розробку