Презентація "Алюміній як хімічний елемент і проста речовина. Сполуки алюмінію"
Про матеріал
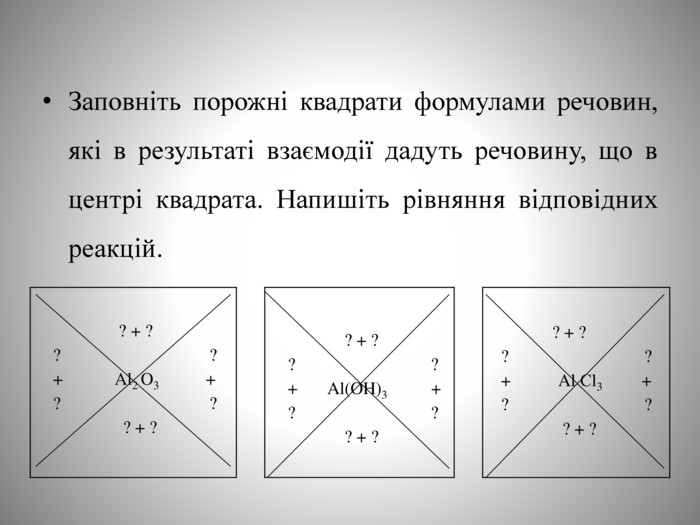
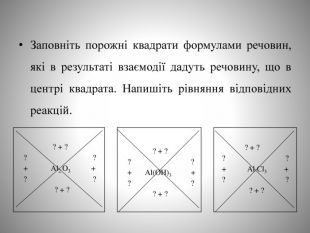
Презентація до уроку "Алюміній". Містить "налаштування на урок", мотивацію, завдання для актуалізації знань, для роботи в групах, для узагальнення знань, практичної частини, домашнє завдання.
Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку