Презентація "Будова ядра атома. Ізотопи. Ядерні сили"
Про матеріал
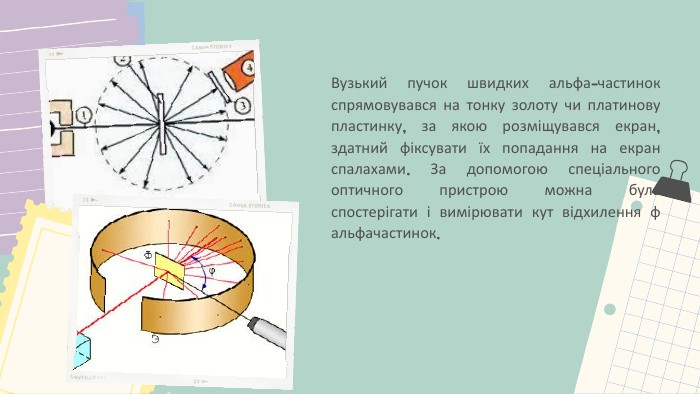
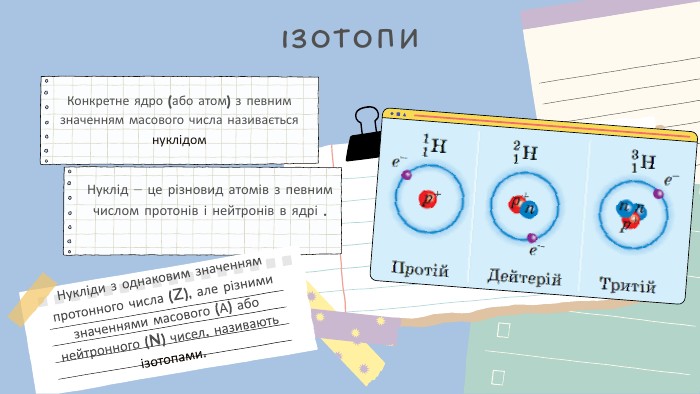
Повчальна презентація для старших класів, з метою вивчення про будову ядра атома - ізіотопи та ядерні сили. Детально розповідається про дослід Резерфорда. Підійде також для 9 класів. Цікаві ілюстрації і приємний дизайн. Перегляд файлу
Зміст слайдів

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку