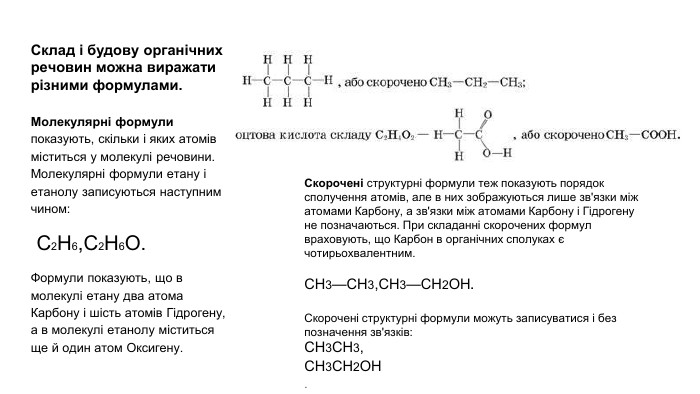
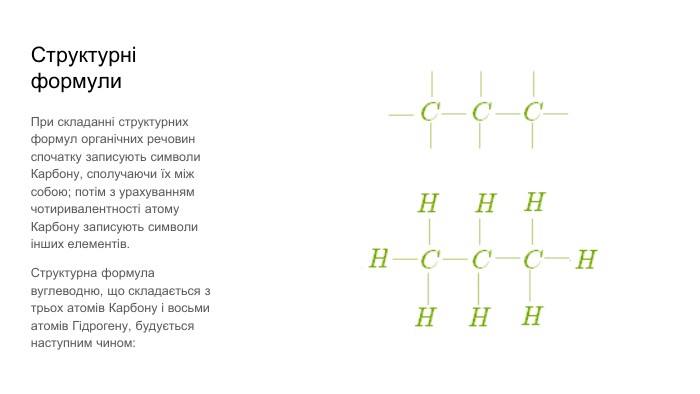
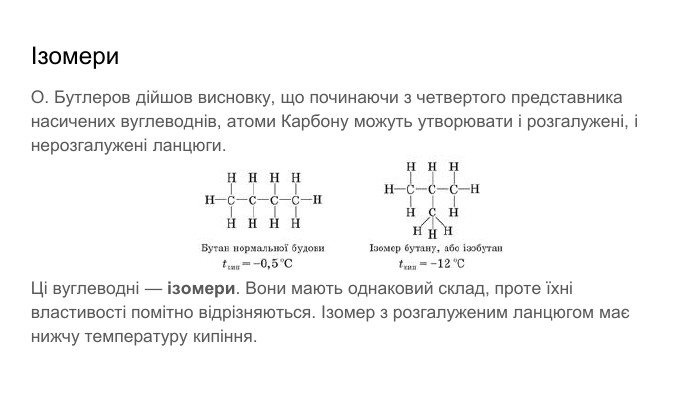
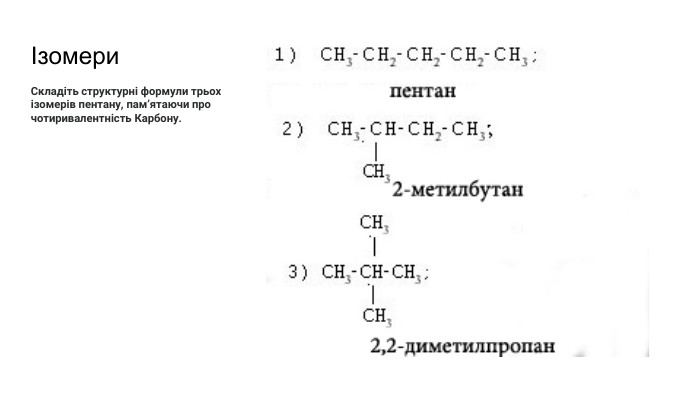
Презентація до уроку "Органічні речовини" (або підготовки до ЗНО/НМТ з хімії)
Про матеріал
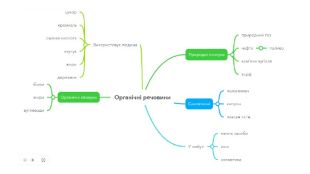
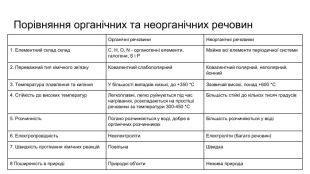
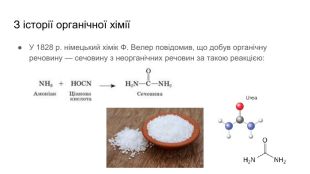
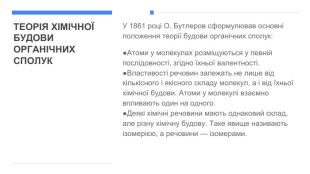
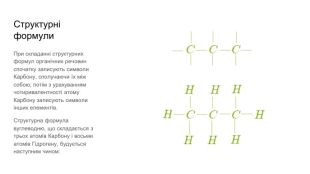
Презентація містить загальну інформацію про органічні речовини. Може бути використана як вступ до органічної хімії.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку