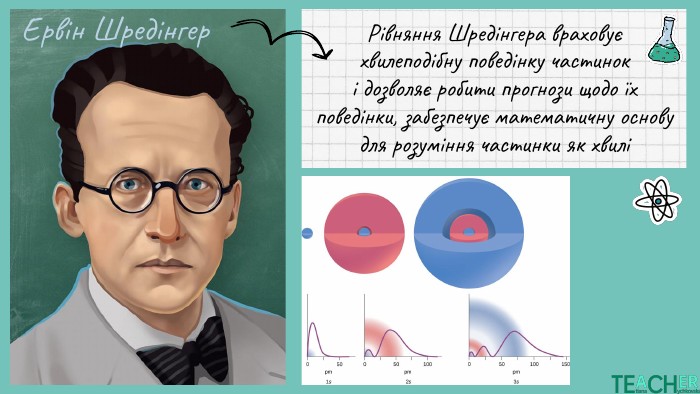
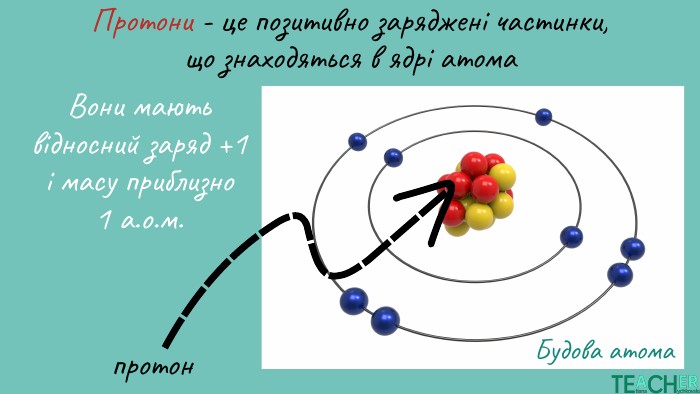
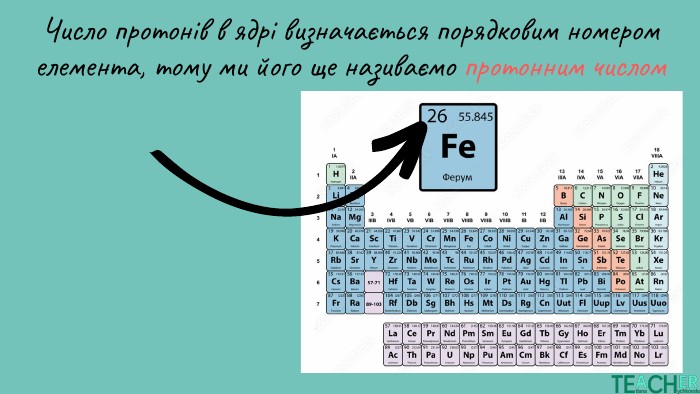
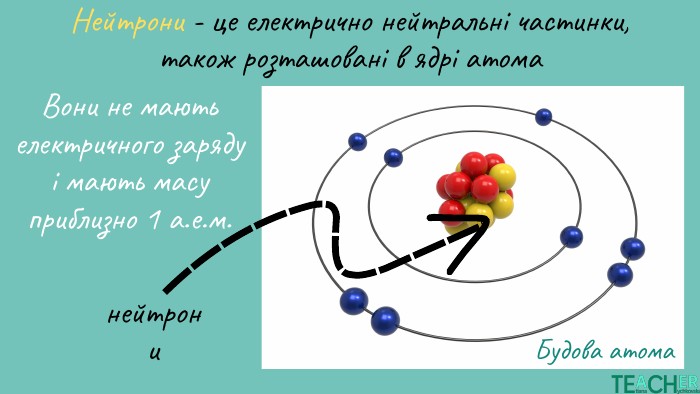
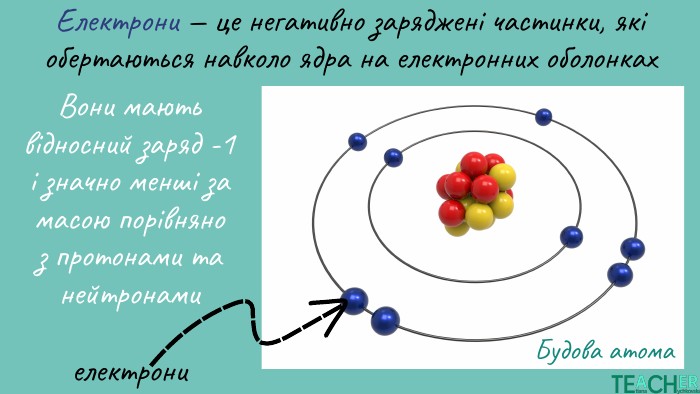
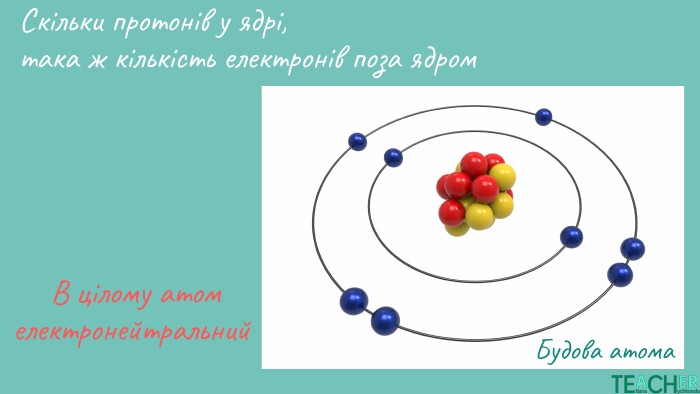
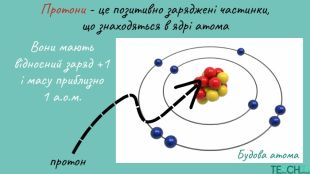
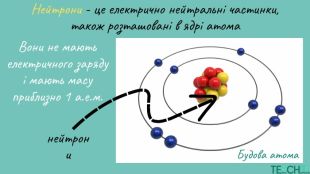
Презентація до уроку: "Будова атома. Протонне число. Нуклонне число"
Про матеріал
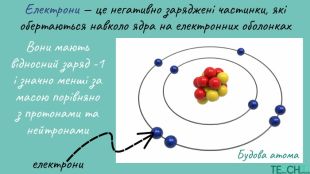
У презентації подано матеріал щодо становлення знань про будову атому, відомі моделі атомів, сучасне поняття будови атома. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
Щиро вдячна!

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку