Презентація до уроку: "Ферменти"
Про матеріал
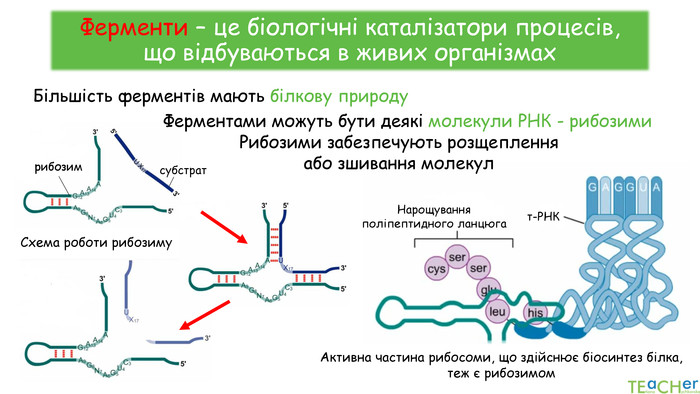
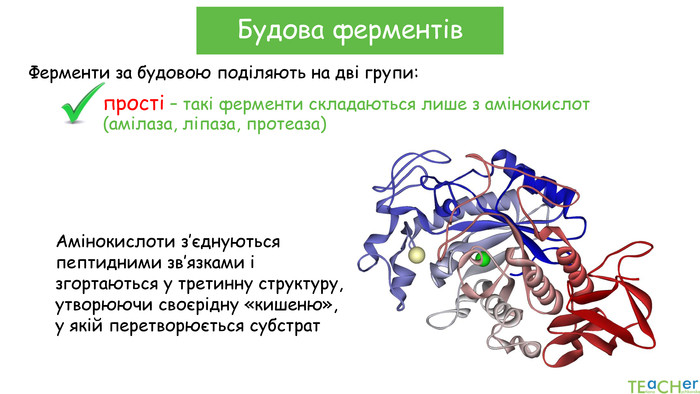
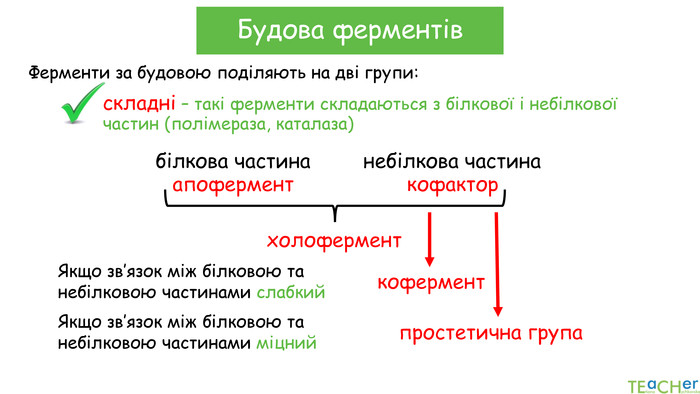
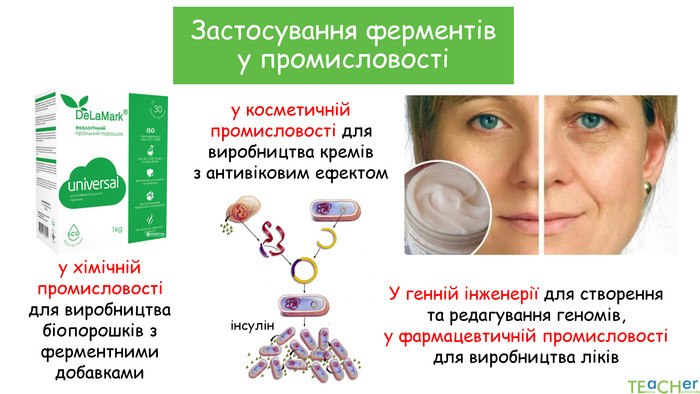
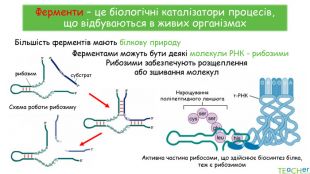
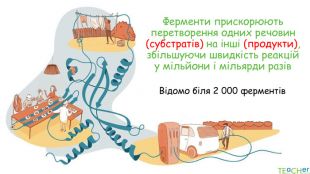
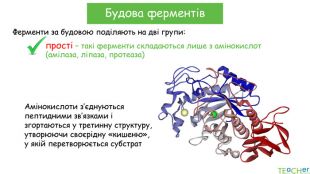
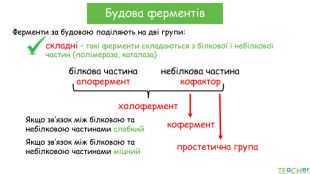
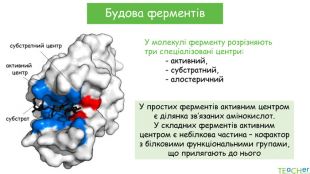
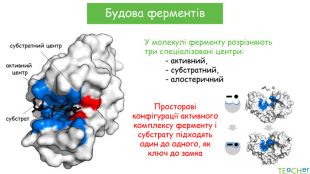
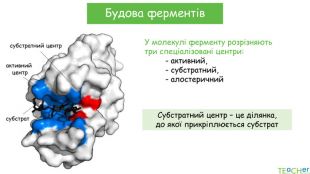
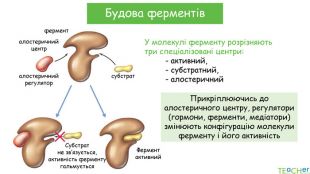
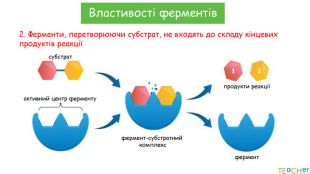
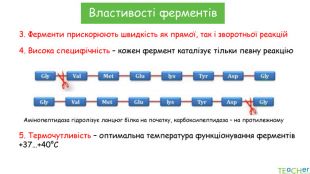
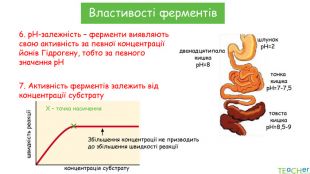
У презентації подано поняття ферментів, природу, класифікацію, будову, властивості, значення ферметів і застосування у галузях промисловості Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



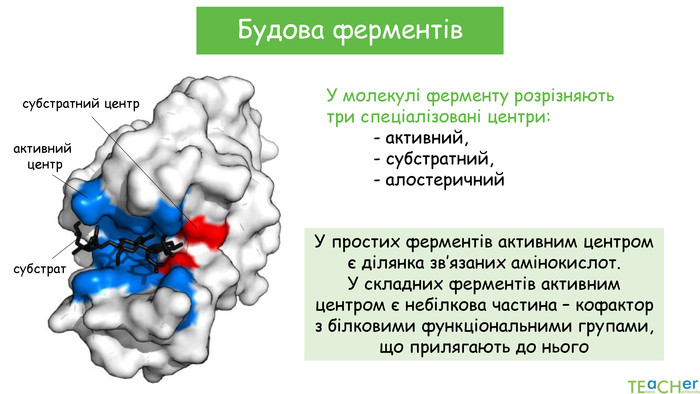
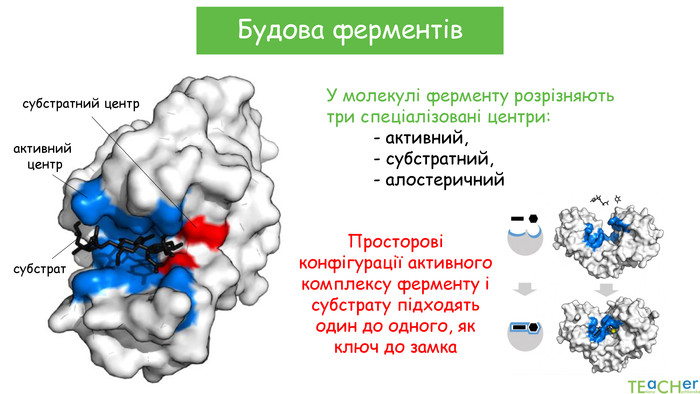
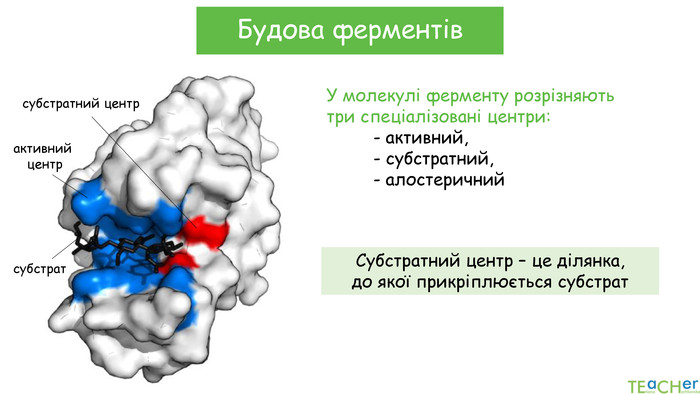
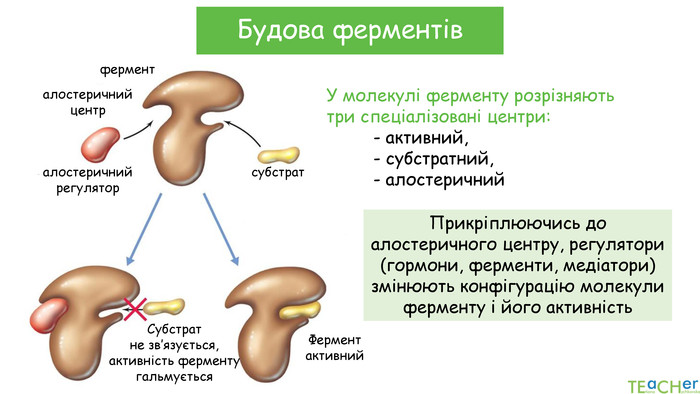














-

Трофімова Тетяна Геннадіївна
18.09.2024 в 15:32
ДЯКУЮ!!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Потапова Галина Іванівна
04.04.2024 в 08:51
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Раєва Алла Фахраддинівна
08.01.2024 в 19:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Луференко Наталія
20.11.2023 в 22:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Волгіна Наталія
01.11.2023 в 21:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Голуб Світлана Василівна
24.09.2023 в 22:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пась Любов Григорівна
21.09.2023 в 16:15
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Олійник Лариса Миколаївна
09.05.2023 в 09:00
спасибі
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Атмажова Наталя Сергіївна
12.02.2023 в 17:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Стожок Алла Павлівна
19.12.2022 в 15:46
ДЯКУЮ!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дигал Людмила
21.11.2022 в 10:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сєдова-Кутішенко Ірина Михайлівна
07.11.2022 в 22:15
Дякую за гарний матеріал!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шепета Людмила Юріівна
26.09.2022 в 09:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Козарик Віктор Богданович
23.09.2022 в 08:37
Презентація 10 з10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ляскало Ольга
21.09.2022 в 16:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дрешер Галина
21.09.2022 в 13:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кулибаба Олена
19.09.2022 в 09:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шафранська Ірина Вікторівна
18.09.2022 в 12:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kugel Tetiana
12.09.2022 в 23:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пашаєва Тетяна Миколаївна
30.05.2022 в 11:02
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Иголкина Яна
11.10.2021 в 21:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мозговая Анна
03.10.2021 в 15:52
Бездоганна презентація! Якісно викладений матеріал і гарно підібрані малюнки!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Труш Олена Олександрівна
28.09.2021 в 19:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пудрій Наталія Георгіївна
16.12.2020 в 23:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Пудрій Наталія Георгіївна
16.12.2020 в 23:44
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Григор'єва Юлія Павлівна
15.10.2020 в 23:06
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Янкіна Тетяна Миколаївна
11.10.2020 в 22:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Єременко Тетяна Василівна
04.10.2020 в 17:31
Дякую! За гарну презентацію
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Отрощенко Юлія Володимирівна
16.08.2020 в 13:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 26 відгуків