Презентація до уроку хімії у 7 класі на тему: "Метали і неметали. Металічні та неметалічні елементи, їх розміщення в періодичній системі"
Про матеріал
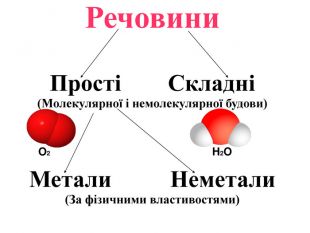
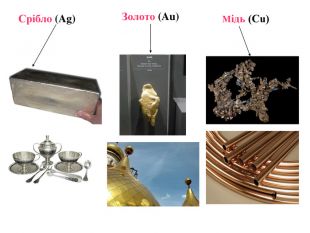
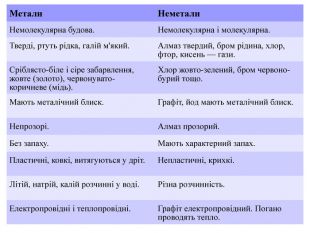
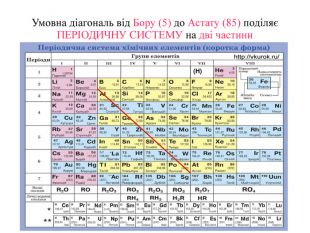
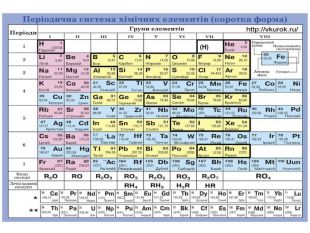
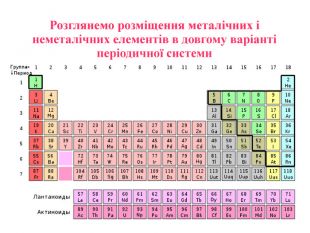
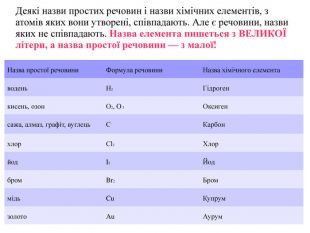
Матеріал містить інформацію про метали і неметали, металічні та неметалічні елементи, їх розміщення в періодичній системі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


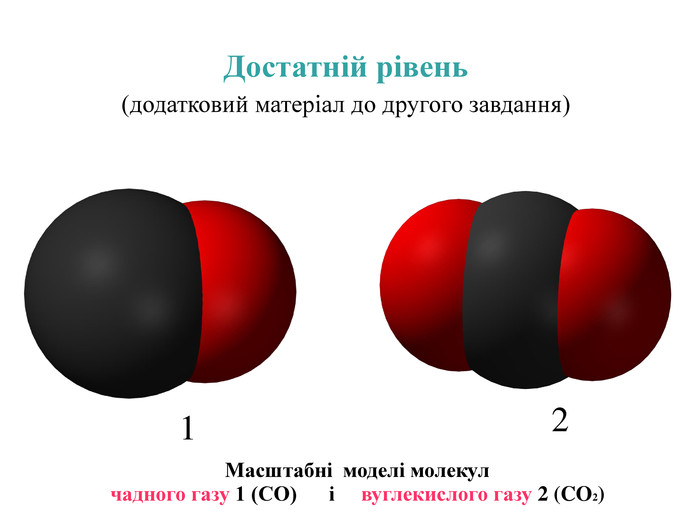

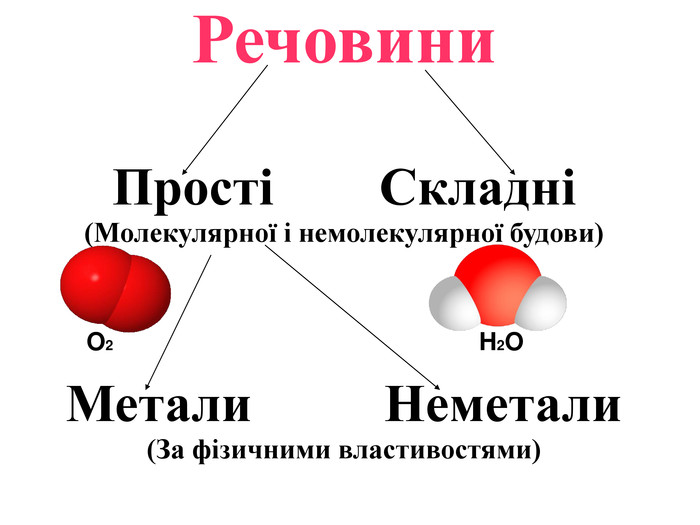














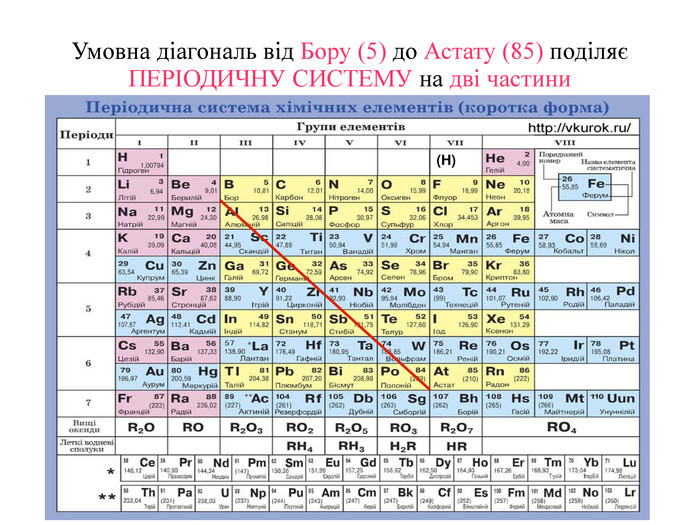

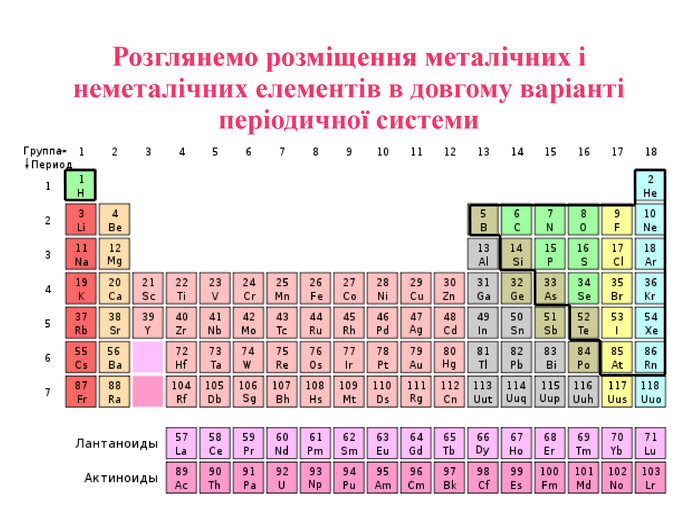




















-

Гончарова Тетяна Олександрівна
11.02.2022 в 09:09
Дякую за такий корисний матеріал!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гурєєва Ольга В'ячеславівна
29.11.2021 в 20:57
Дякую! Дуже змістовно, чітко, послідовно.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дробот Олена Геннадіївна
15.12.2020 в 19:25
Дякую за вашу роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тарасенко Людмила Іванівна
09.11.2020 в 22:20
Величезна подяка за Вашу розробку!
Все викладено чітко, логічно, послідовно, а використання ілюстрацій зацікавлює учнів до вивчення хімії!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сергей Примаченко
22.03.2020 в 22:32
Розробка дуже гарна, все структуровано і послідовно. Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука