Презентація до уроку "Хімічні властивості кисню. Реакції сполучення. Поняття про оксиди"
Про матеріал
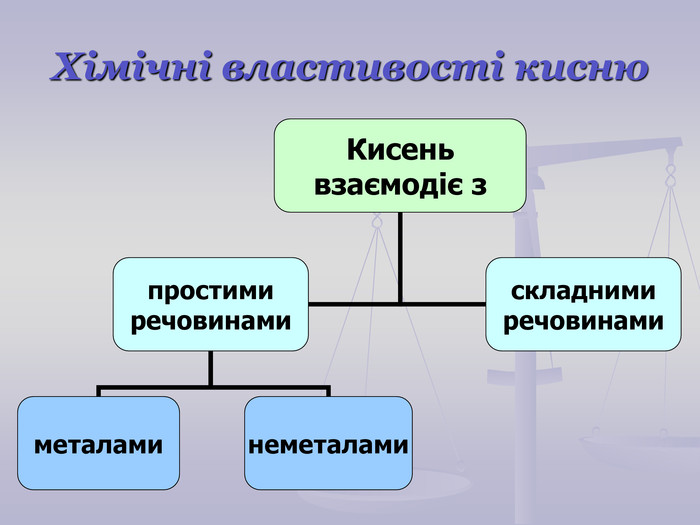
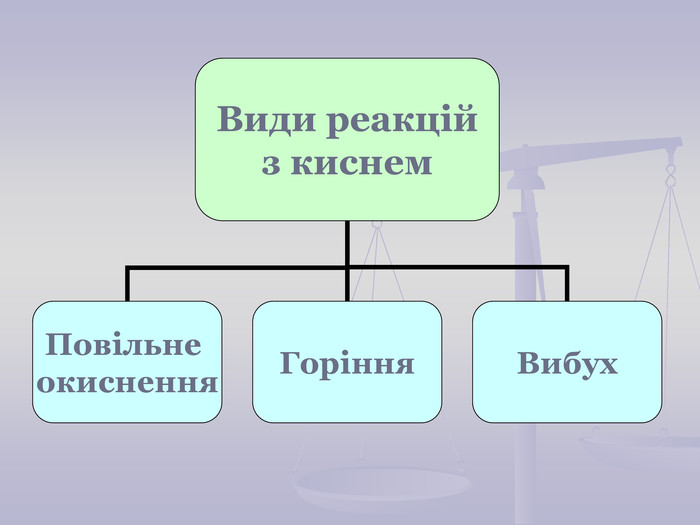
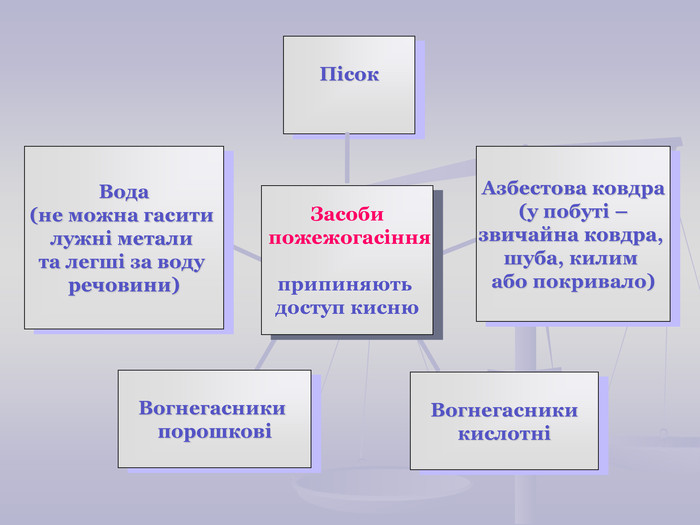
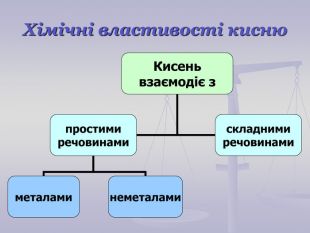
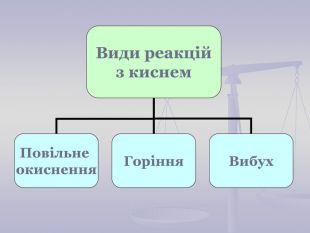
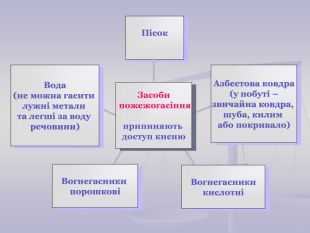
Презентація до уроку "Хімічні властивості кисню: взаємодія з вугіллям, сіркою, фосфором. Реакції сполучення. Поняття про оксиди" для 7 класу. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку