Презентація до уроку на тему : "Добування кисню в лабораторії та промисловості. Реакція розкладу. Поняття про каталізатор"
Про матеріал
Завдання:
дидактична:
• створити умови для усвідомлення й осмислення учнями нової навчальної інформації;
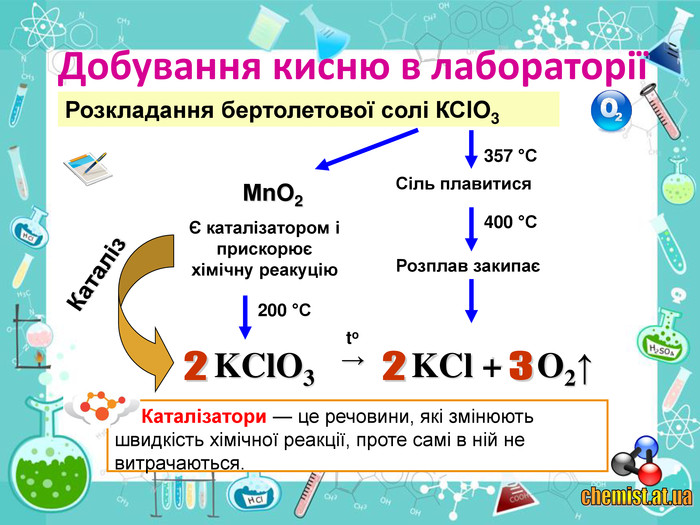
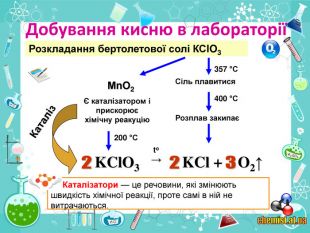
• сформувати поняття учнів про каталізатор;
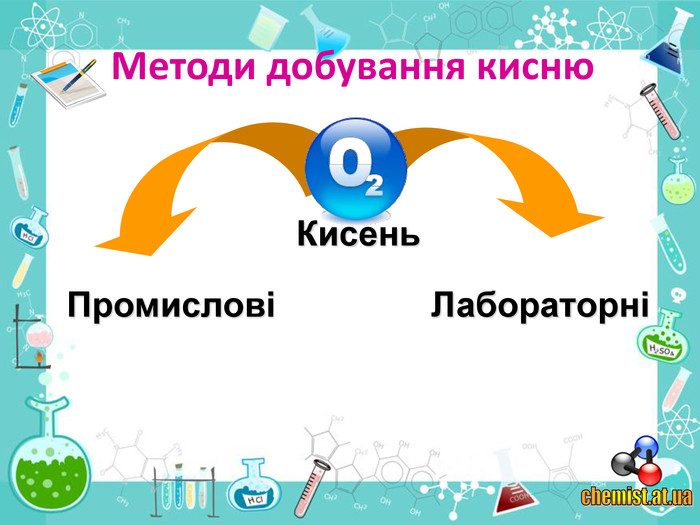
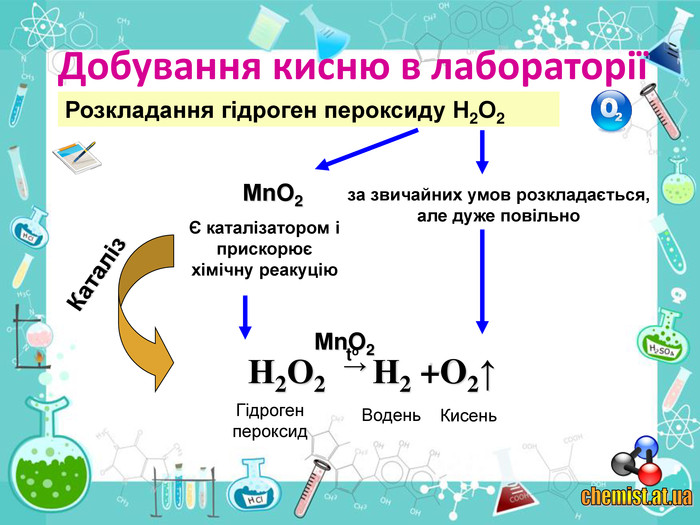
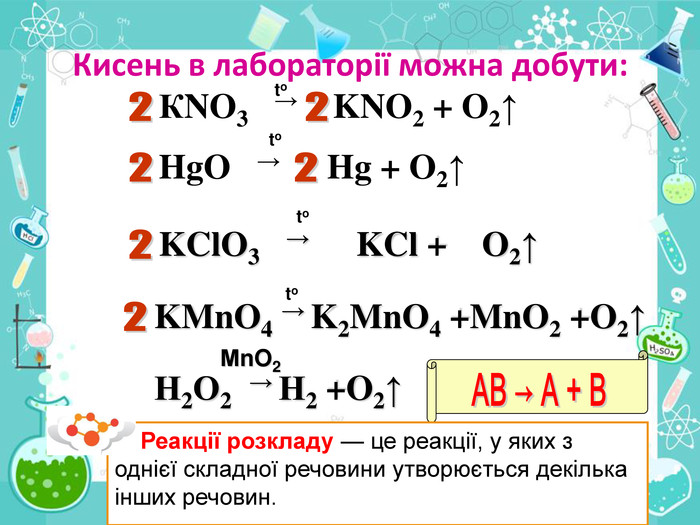
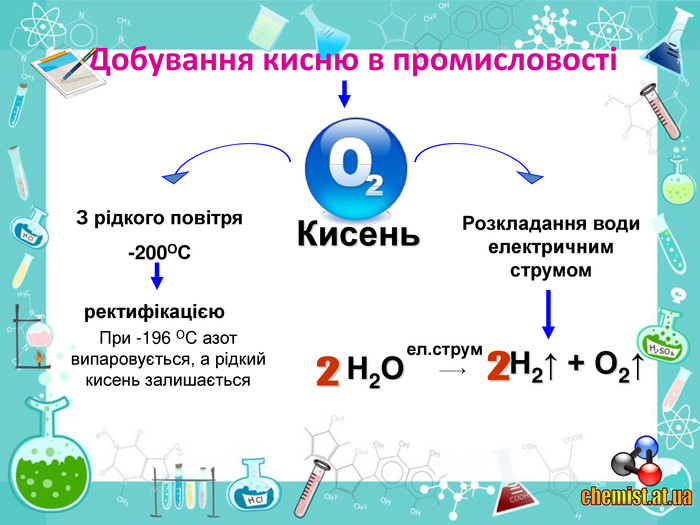
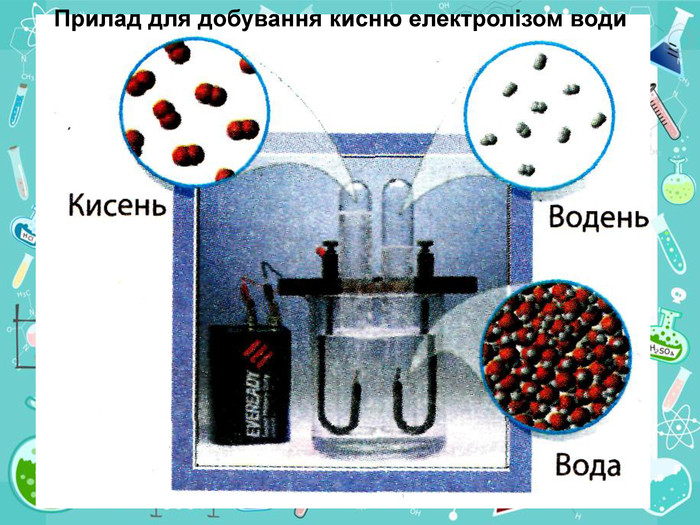
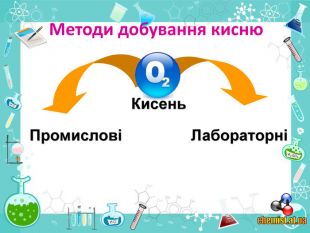
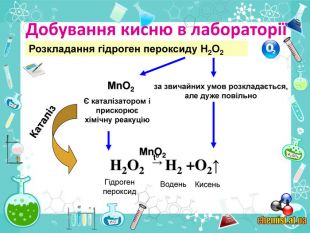
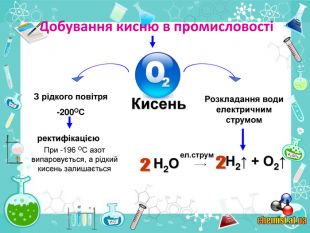
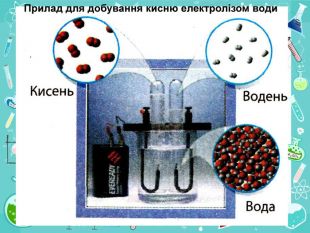
• познайомити учнів із методами добування кисню в хімічній лабораторії та промисловості;
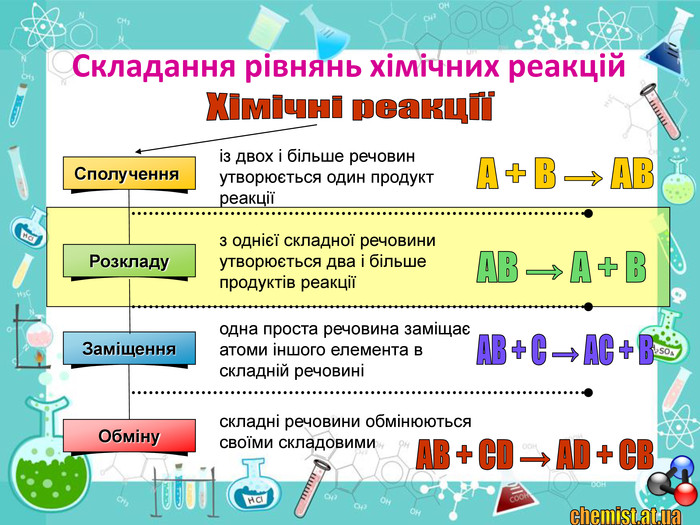
• пояснити суть реакцій розкладу та з’ясувати її ознаки;
• розкрити значення хімічних процесів у житті людини;
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



























-

Романова Людмила Олексіївна
25.01.2024 в 11:36
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полуда Тетяна Олександрівна
02.03.2023 в 18:06
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
02.03.2023 в 00:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Осіпчук Валентина
10.02.2023 в 22:22
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гарбарчук Ольга Анатоліївна
09.02.2022 в 20:04
Хороша презентація!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

фертак наталя
08.02.2022 в 14:22
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ципльонок Валентина Володимирівна
30.01.2022 в 17:58
Дякую ! Гарна робота.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука