Презентація з хімії - " Періодичний закон та періодична система"
Презентація з хімії - " Періодичний закон та періодична система"
Презентація до уроку надає короткі історичні відомості про спроби класифікації хімічних елементів, поняття про лужні, інертні елементи, галогени. Пояснює сутність періодичного закону Д.І. Менделєєва, будову періодичної системи хімічних елементів.
Наводить б удову атому, склад атомних ядер (протони і нейтрони) ,протонне число, нуклонне число.,нуклід, ізотопи.Сучасне формулювання періодичного закону.
Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах елементів 1-3 періодів. Електронні та графічні електронні формули атомів. Основний і збуджений стани атома. Поняття про радіус атома.
Періодична система хімічних елементів з позиції теорії будови атома.
Характеристика хімічних елементів малих періодів за їх місцем у періодичній системі та будовою атома.
Значення періодичного закону
Презентація з історія відкриття періодичної системи хімічних елементів дозволить наочно продемонструвати дітям упорядкований світ хімії.


























В кінці ХVІІІ ст. А.-Л. Лавуазьє запропонував першу класифікацію хімічних елементів. Він розділив прості речовини на метали і неметали. Така класифікація була недосконалою, але розподіл простих речовин, а також хімічних елементів на дві великі групи відіграло важливу роль у розвитку хімії.
У ХІХ ст. німецький вчений В. Деберейнер розподілив частину подібних елементів на тріади.1 тріада - лужні елементи2 тріада – лужноземельні4 тріада – галогени. Розмістив їх за збільшенням атомних мас. Закономірність: напівсума елементів приблизно дорівнює відносній атомній масі середнього елемента.
Він помітив, що в багатьох випадках кожний восьмий елемент є подібним до обраного за перший (таку особливість має звуковий ряд у музиці). Тому таку закономірність виявлену цим ученим назвали правилом октав. У 1865. англійський вчений Дж. Ньюлендс розмістив відомі тоді хімічні елементи у ряд за зростанням відносних атомних мас. H, Li, Be, B, C, N, O, F, Na, Mg, Al, Si, P, S, Cl, K, Ca, Cr,Ti, Mn, Fe…style.colorfillcolorfill.type
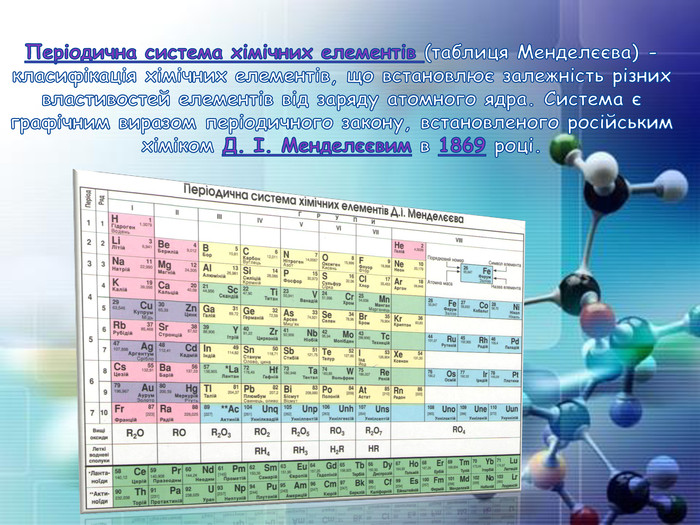
Періодична система хімічних елементів (таблиця Менделєєва) - класифікація хімічних елементів, що встановлює залежність різних властивостей елементів від заряду атомного ядра. Система є графічним виразом періодичного закону, встановленого російським хіміком Д. І. Менделєєвим в 1869 році.
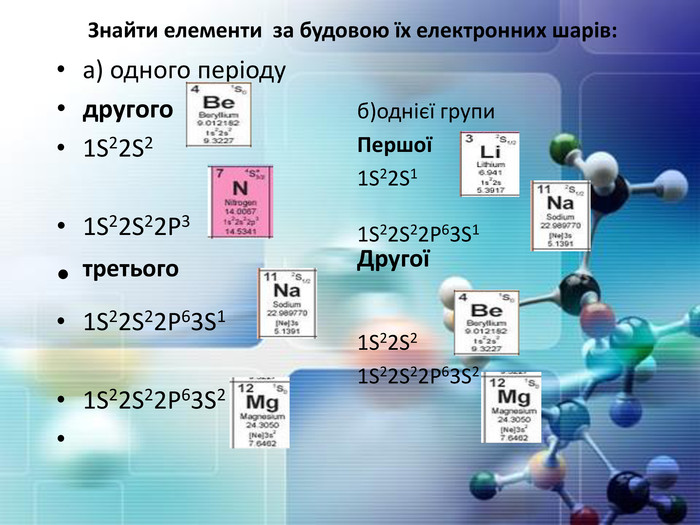
Група - вертикальний стовпчик у таблиці Менделєєва, у якому розміщені подібні за властивостями хімічні елементи. У короткоперіодному варіанті Періодичної системи кожна група поділяється на підгрупи — головну (або А) і побічну (Б). До складу головної підгрупи входять елементи великих і малих періодів, а до складу побічних підгруп — тільки великих періодів і лише метали. У групах у головних підгрупах виявляється подібність елементів (наприклад однакова вища валентність) та їхніх сполук (наприклад загальні формули вищих оксидів і водневих сполук). У групах із зростанням порядкового номера металічні властивості елементів посилюються, а неметалічні послаблюються.
Періоди- горизонтальні ряди в таблиці Менделєєва. Періодів усього сім. Періоди поділяються на малі, що складаються з одного ряду (1—3 періоди), і великі, що складаються з двох рядів (4—7 періоди). У періодах добре помітна періодичність зміни властивостей елементів, простих речовин, утворених цими елементами, та їх сполук. У періодах із зростанням порядкового номера елементів їх металічні властивості слабшають, а неметалічні посилюються.
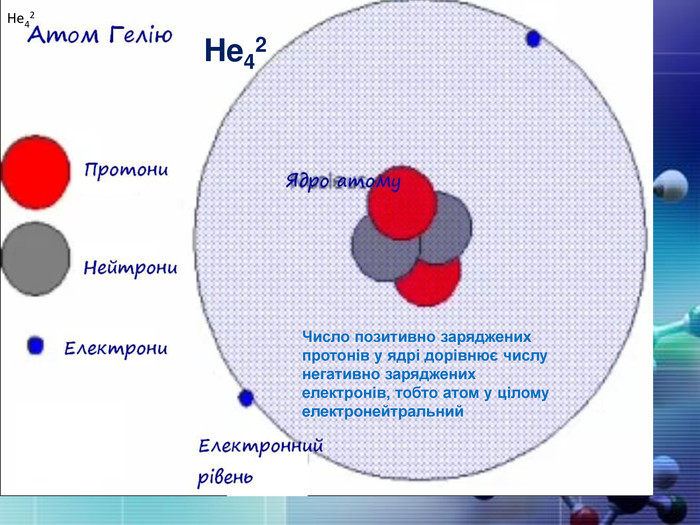
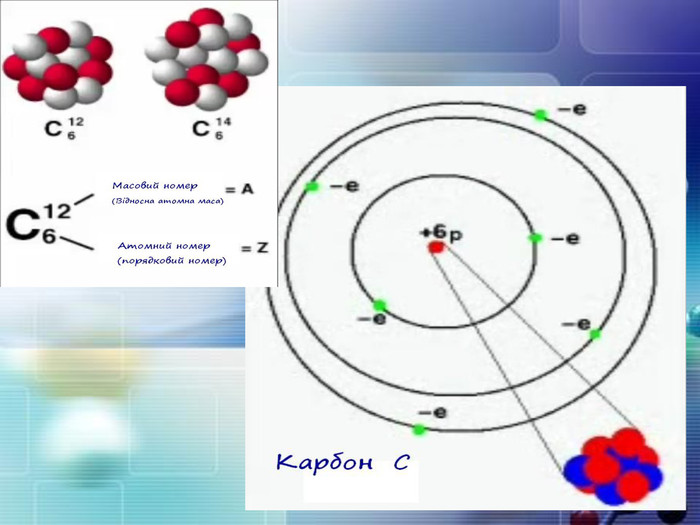
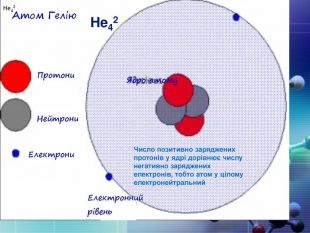
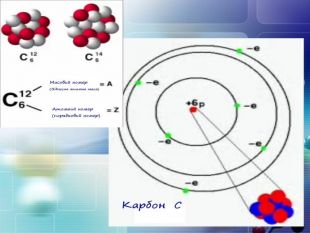
Теорія будови атома. Атом — це електронейтральна частинка, що складається з позитивно зарядженого ядра, нейтральних часток нейтронів і негативно заряджених електронів. Ядра атомів складаються з елементарних частинок двох видів: протонів (p) і нейтронів (n). Сума протонів і нейтронів у ядрі одного атома називається нуклонним числом де А — нуклонне число, N — число нейтронів, Z — число протонів.
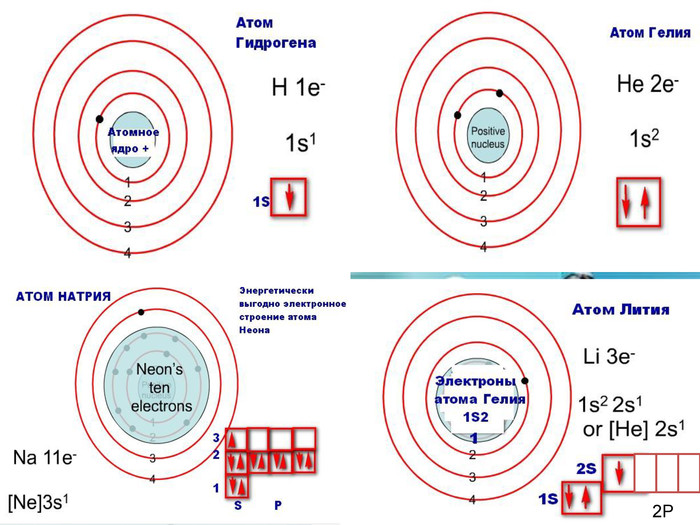
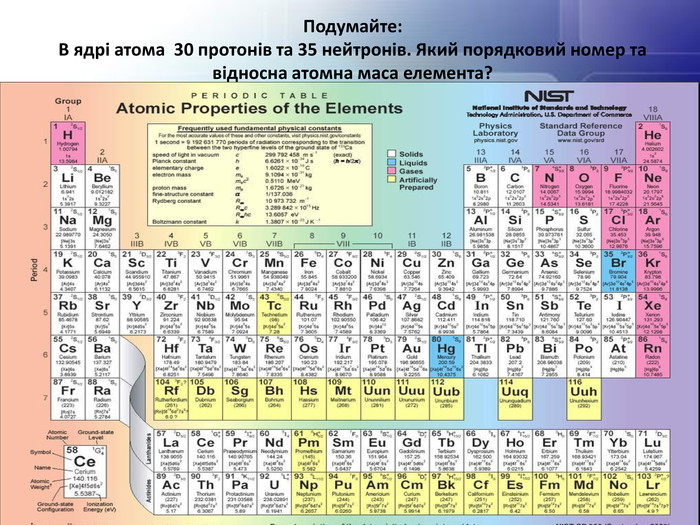
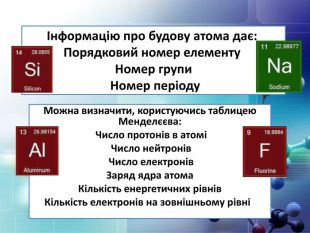
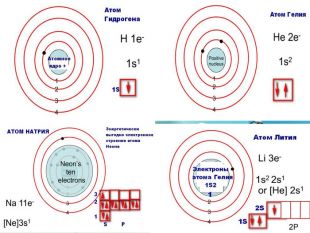
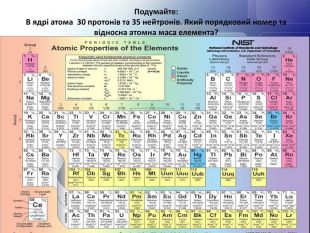
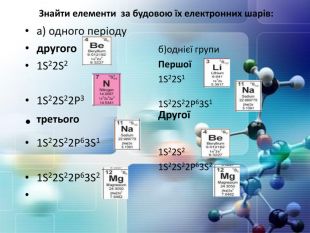
Порядковий номер елементу – загальне число електронів у атомі, які утворюють електронну оболонку атома. Порядковий номер елемента – кількість протонів у ядрі та заряд ядра ZЕлектрони по різному притягуються до атома і утворюють електронні шари або рівні. Номер періоду – кількість електронних шарів - n. Кожний електронний шар складається з електронних орбіталей певної форми. Кількість орбіталей визначається n2 А орбіталь позначується клітинкою. Не може бути більш ніж 2 електрони на одній орбіталі. Кількість електронів на енергетичному рівні 2 n2
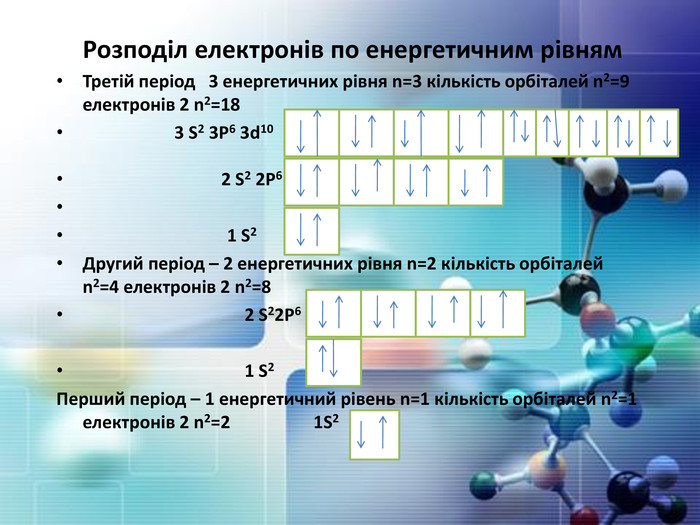
Розподіл електронів по енергетичним рівням. Третій період 3 енергетичних рівня n=3 кількість орбіталей n2=9 електронів 2 n2=18 3 S2 3 P6 3d10 2 S2 2 P6 1 S2 Другий період – 2 енергетичних рівня n=2 кількість орбіталей n2=4 електронів 2 n2=8 2 S22 P6 1 S2 Перший період – 1 енергетичний рівень n=1 кількість орбіталей n2=1 електронів 2 n2=2 1 S2
Фізичний зміст Періодичного закону В атомах елементів із зростанням порядкового номера відбувається збільшення кількості протонів у ядрі й електронів, що обертаються навколо ядра. При цьому періодично повторюється будова зовнішнього енергетичного рівня. Оскільки властивості елементів багато в чому залежать від числа електронів на зовнішньому енергетичному рівні, то й вони періодично повторюються. Сучасне формулювання Періодичного закону: Властивості хімічних елементів, а також форми й властивості сполук елементів перебувають у періодичній залежності від заряду ядер їхніх атомів.
Періодичний закон відкритий Д. І. Менделєєвим в березні 1869 року при зіставленні властивостей всіх відомих на той час елементів і величин їхніх атомних мас (ваг). Термін «періодичний закон» Д.І. Менделеев вперше вжив у листопаді 1870, а в жовтні 1871 дав остаточне формулювання періодичного закону: «... властивості елементів, а тому і властивості утворених ними простих і складних тіл, знаходяться у періодичній залежності від їх атомних мас, та зарядів атомних ядер». Графічним (табличним) зображенням періодичного закону є розроблена Менделєєвим періодична система елементів.
Дмитро Іванович Менделєєв народився 8 лютого1834 року у Тобольську, у родині директора місцевої гімназії. З 1850 р. навчався на фізико-математичному факультеті Петербурзького педагогічного інституту. У 1855 р. закінчив його з золотою медаллюІван Павлович Менделєєв, батько вченого. Марія Дмитрівна Менделєєва, мати вченого. Дмитро Іванович Менделеев, 1885 год. Тобольська гімназія, у якій вчився Д.І. Менделєєв. Вид Тобольска
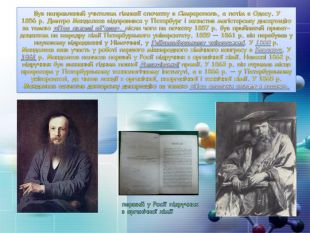
Був направлений учителем гімназії спочатку в Сімферополь, а потім в Одесу. У 1856 р. Дмитро Менделєєв відправився у Петербург і захистив магістерську дисертацію за темою «Про питомі об'єми», після чого на початку 1857 р. був прийнятий приват-доцентом на кафедру хімії Петербурзького університету. 1859 — 1861 р. він перебував у науковому відрядженні у Німеччині, у Гейдельберзькому університеті. У 1860 р. Менделєєв взяв участь у роботі першого міжнародного хімічного конгресу в Карлсрує. У 1861 р. Менделєєв написав перший у Росії підручник з органічної хімії. Навесні 1862 р. підручник був визнаний гідним повної Демидівської премії. У 1863 р. він отримав місце професора у Петербурзькому технологічному інституті, а в 1866 р. — у Петербурзькому університеті, де читав лекції з органічної, неорганічної і технічної хімії. У 1865 р. Менделєєв захистив докторську дисертацію за темою «Про сполуки спирту з водою».перший у Росії підручник з органічної хімії
У наступні роки з-під пера Менделєєва вийшло ще кілька основних праць з різних розділів хімії. Його повна наукова і літературна спадщина величезна і містить 431 роботу. Праці Менделєєва отримали широке міжнародне визнання. Він був обраний членом багатьох академій наук, іноземних наукових товариств. Тільки Російська академія наук на виборах 1880 р. забалотувала його через внутрішні інтриги. Пішовши в 1890 у відставку, Менделєєв брав активну участь у виданні Енциклопедичного словника Брокгауза й Ефрона, був консультантом у пороховій лабораторії при Морському міністерстві. Провівши необхідні дослідження, усього за три роки він розробив ефективний склад бездимного пороху. У 1893 р. Менделєєв був призначений хранителем (керівником) Головної палати мір і ваги. Помер у лютому 1907 р. в Санкт-Петербургу від запалення легень. Могила Д.І. Менделєєва на Волковому кладовищи. Пам'ятник Д.І. Менделєєву


про публікацію авторської розробки
Додати розробку



























-

Остаповець Юрій
09.10.2023 в 21:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
21.09.2023 в 08:33
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Яцишина Людмила Анатоліївна
04.10.2021 в 21:19
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лещенко Надія Павлівна
13.10.2018 в 20:18
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крсек Алла Геннадіївна
28.02.2018 в 22:13
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Soyka Taya
20.02.2018 в 22:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Малієнко Валентина Іванівна
19.02.2018 в 17:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 4 відгука