Презентація до уроку на тему " Спирти"
Про матеріал
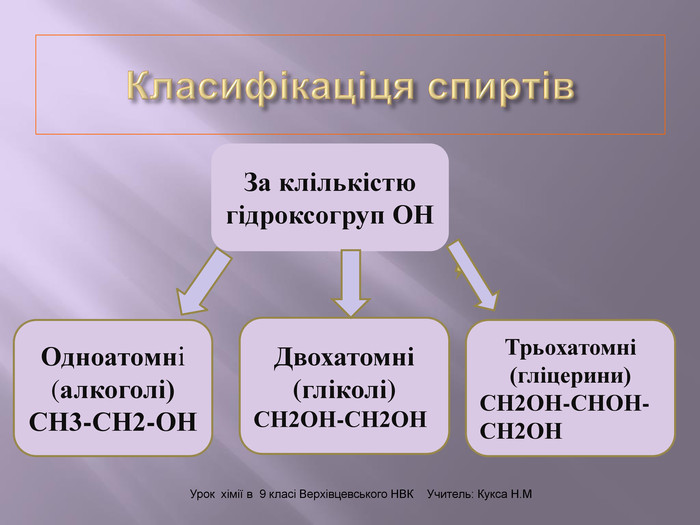
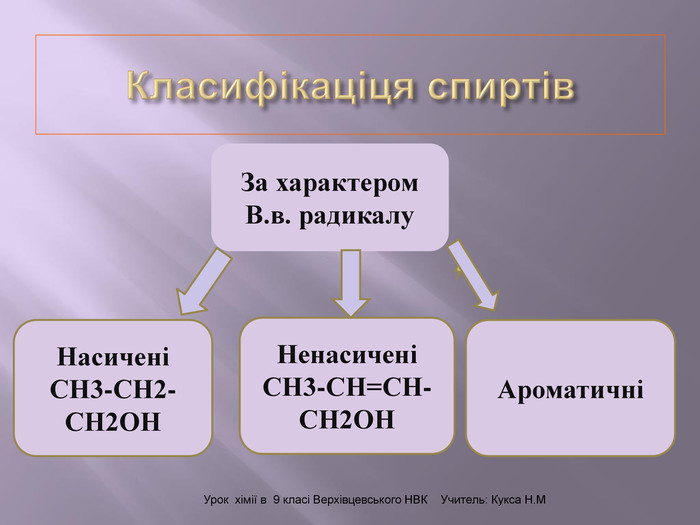
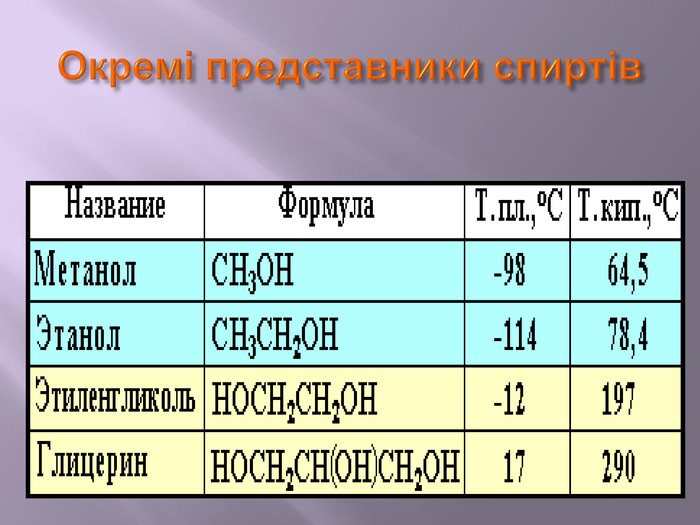
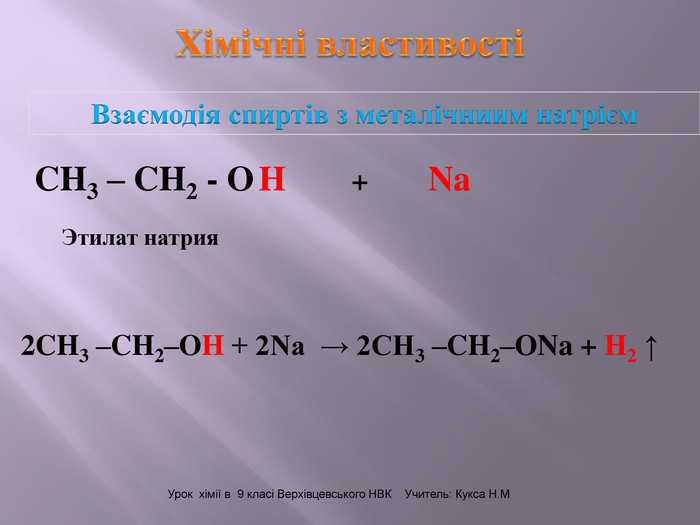
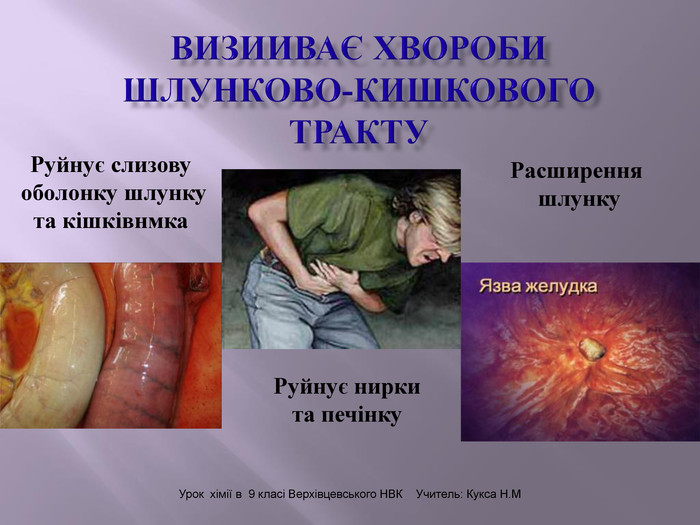
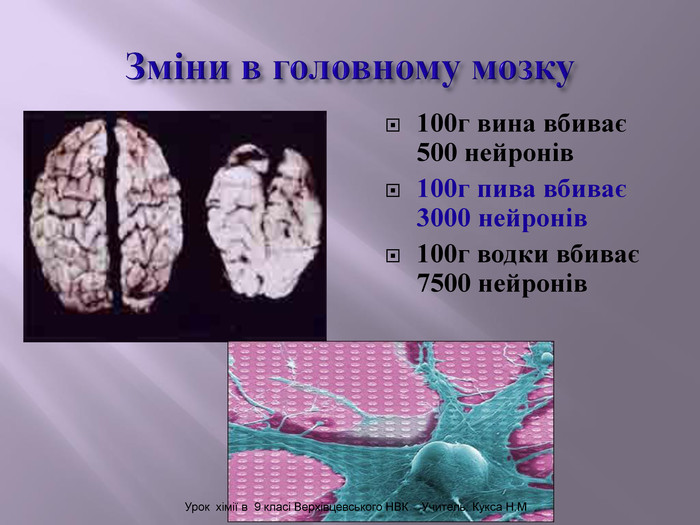
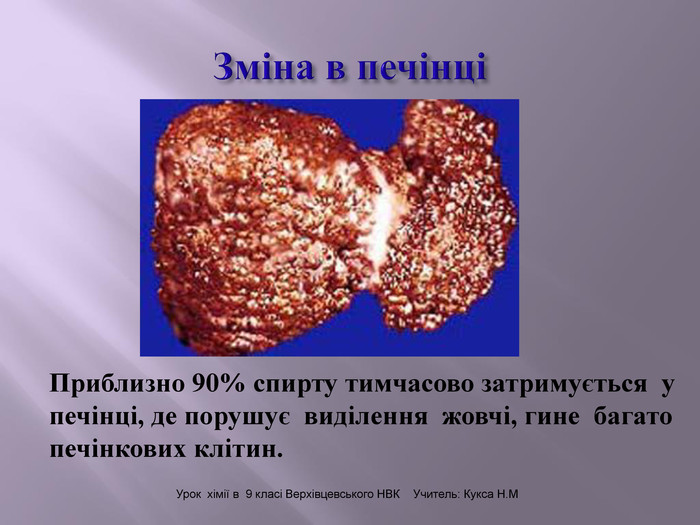
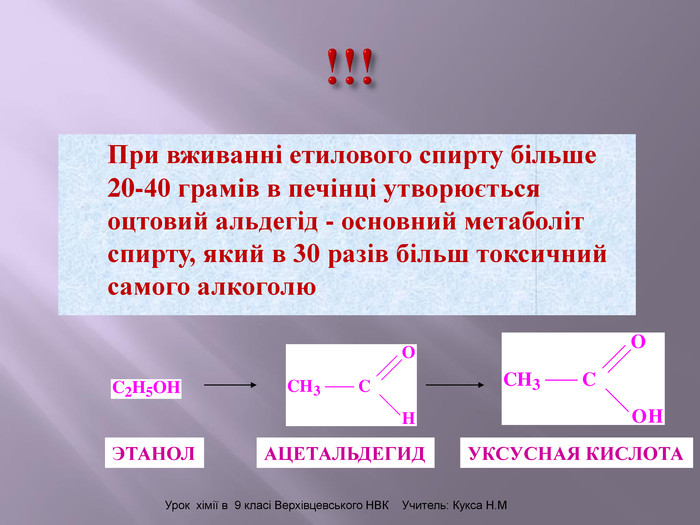
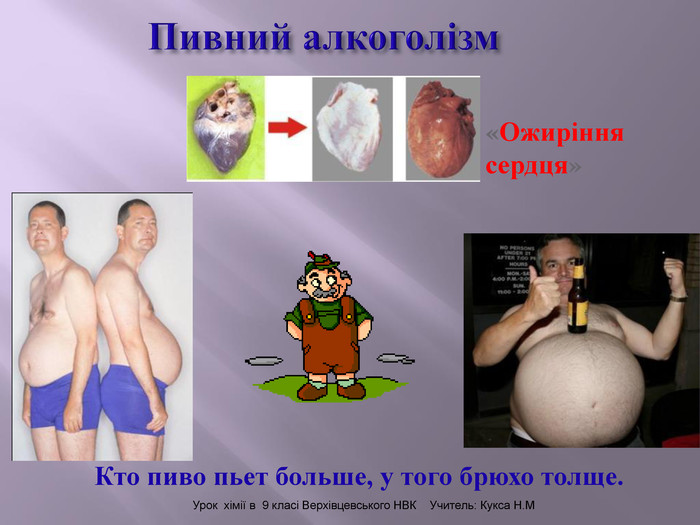
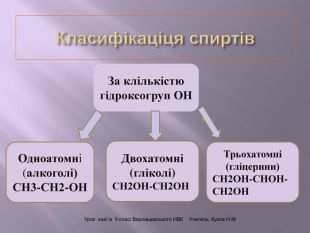
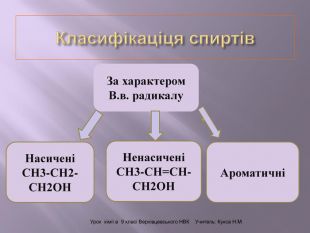
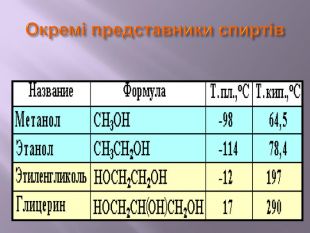
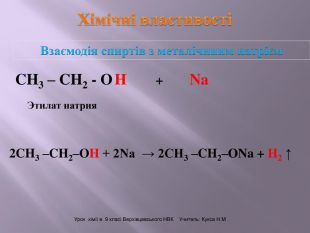
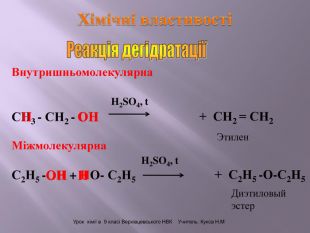
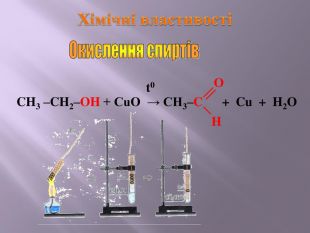
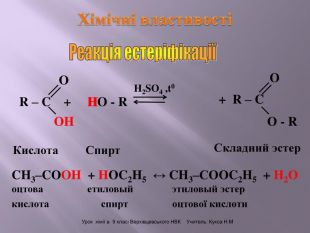
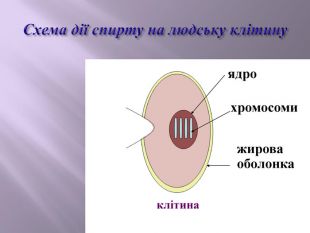
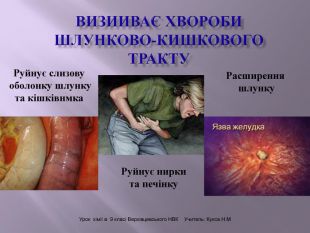
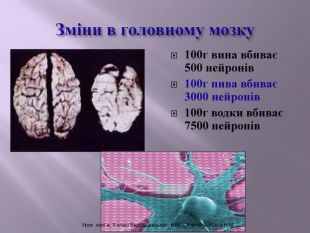
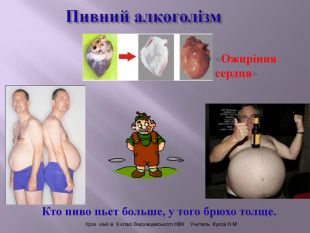
Презентація до уроку на тему " Спирти" дає можливість учням визначати, які речовини відносять до спиртів, яку класифікацію мають спирти, будову молекул спиртів та їх властивості. А також вплив спиртів на організм та як спирти добувають та застосувають.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку