Презентація до уроку: "Радіус атома. Металічні та неметалічні властивості елементів"
Про матеріал
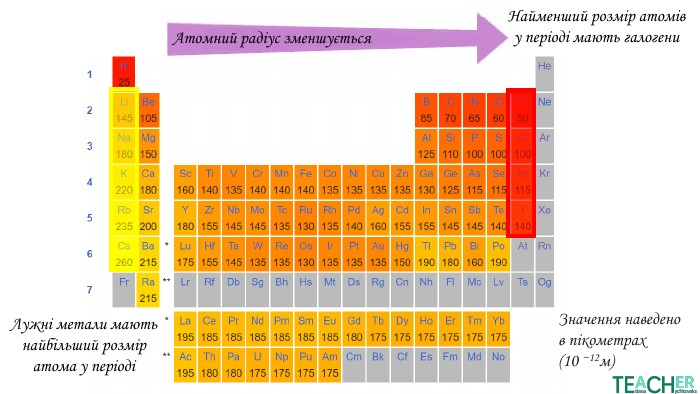
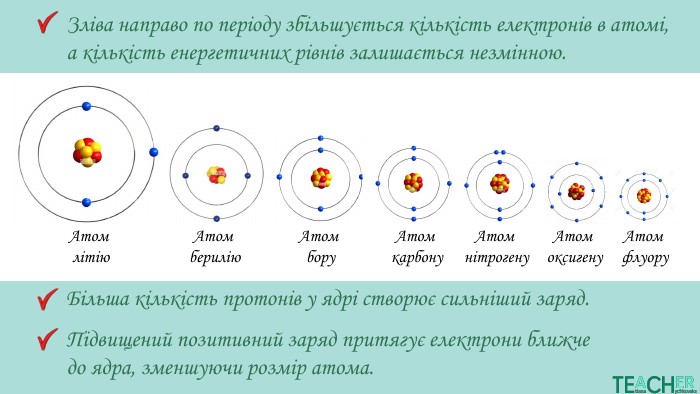
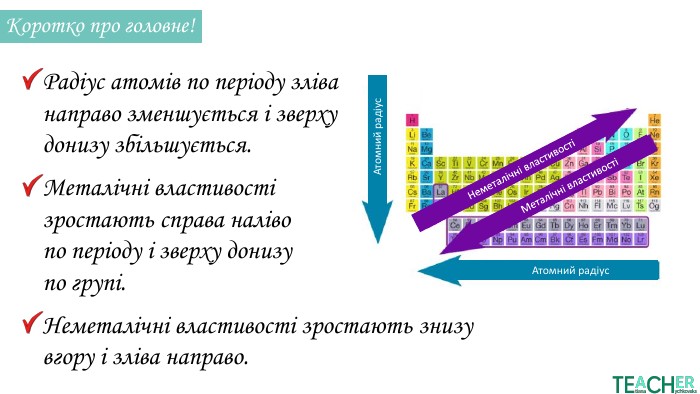
У презентації подано матеріал про радіус атома, його зміни по періоду та групі, а також зміни металічності та неметалічності елементів залежно від розташування у періодичній системі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дуже дякую!

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку