Презентація до уроку з хімії для 8 класу "Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома"












Це актуально!1) Чим можна пояснити періодичну зміну властивостей елементів, розташованих у періодичній системі? 2) В залежності від того, який підрівень заповнюється електронами, елементи поділяються на родини. - які елементи відносяться до S- елементів?- які елементи відносяться до р- елементів?- які елементи відносяться до d - елементів? - які елементи відносяться до f - елементів?
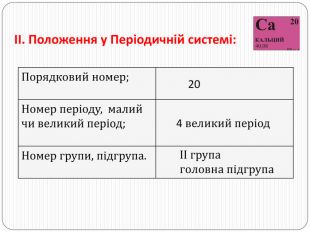
3) Як змінюється радіус атомів елементів, розташованих в одному періоді? Чим це можна пояснити?4) Як змінюється радіус атомів елементів, розташованих в одній групі головній підгрупі? Чим це можна пояснити?5) Як змінюється металічні та неметалічні властивості елементів, розташованих в одному періоді? Чим це можна пояснити?
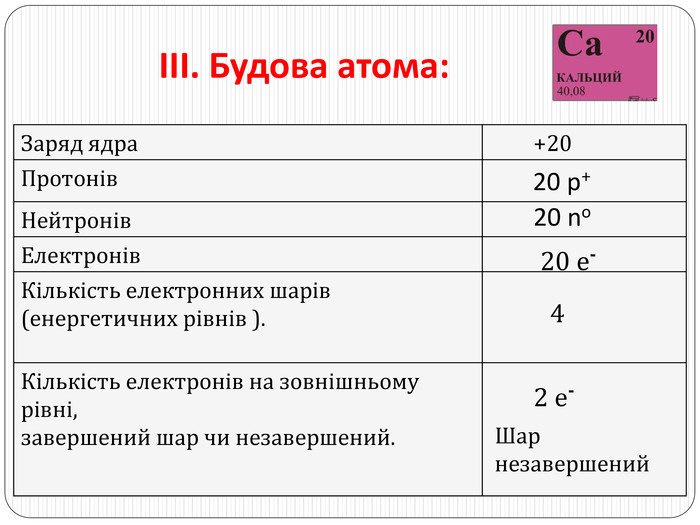
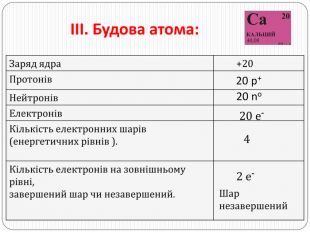
ІV. Характер хімічного елемента: s-елемент; металічний елемент. V. Назва та формула простої речовини. Кальцій Са - лужноземельний метал. VІ. Характер сполук хімічного елемента{5940675 A-B579-460 E-94 D1-54222 C63 F5 DA}Вищий оксид. Гідрат оксиду. Летка сполука з Гідрогеном. Са. О кальцій оксид виявляє основні властивостіСа(ОН)2 кальцій гідроксид, луг. Не утворюється
VІІ. Порівняння металічних властивостей із властивостями елементів, що стоять поряд у періоді та групі. Са проявляє металічні властивості слабше за Mg, але сильніше за Sr, оскільки радіус атома Са (4 енергетичні рівні) більший, ніж у Mg (2 енергетичні рівні) і менший, ніж у Sr (5 енергетичних рівнів). Тому Са притягує валентні електрони слабше за Mg, але сильніше за Sr. Са проявляє металічні властивості слабше за К, але сильніше за Sс, оскільки заряд ядра Са (+20) більший, ніж у К (+19) і менший, ніж у Sс (+21). Тому Са притягує валентні електрони сильніше, ніж К і слабше, ніж Sс.
Додаткові вправи для закріплення матеріалу1. Користуючись планом характеристики хімічного елемента, схарактеризуйте Хлор, Карбон.2. В атомі хімічного елемента електрони розподілені по енергетичних рівнях так: 2, 8, 6. Визначте місце цього елемента в періодичній системі; характер простої речовини, яку утворює цей елемент; склад і характер його вищого оксиду та гідроксиду; склад леткої сполуки з Гідрогеном, якщо цей елемент її утворює. 3. Зазначте склад і назву вищого оксиду хімічного елемента з атомним номером 14. Поясніть характер цього оксиду. 4. Відомо, що металічні властивості Магнію виражені слабкіше, ніж Натрію, але сильніше, ніж Алюмінію. Дайте пояснення.
5. Обґрунтуйте, чи будуть вищі оксиди елементів з атомними номерами 6, 11, 18 взаємодіяти з кислотою. Напишіть рівняння можливих реакцій.6. Назвіть елемент п’ятого періоду, який є найтиповішим неметалічним елементом. Чому? 7. Визначте хімічний елемент, якщо відомо, що в його атомі два електронних шари, а склад леткої сполуки з Гідрогеном відповідає формулі RH2. Яку просту речовину — метал або неметал — утворює цей елемент? Відповідь мотивуйте. 8. Порівняйте будову електронних оболонок атомів елементів з атомними номерами: а) 7 і 15; б) 17 і 18. Знайдіть подібність і відмінність у будові атомів цих елементів. Поясніть, як це позначається на їх властивостях.


про публікацію авторської розробки
Додати розробку













-

Крамар Світлана
16.11.2023 в 23:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тодоров Андрей
02.11.2023 в 12:57
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Мельник Людмила
01.11.2023 в 10:40
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Гнатюк Віра Олексіївна
31.10.2023 в 07:12
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грищенко Ірина Володимирівна
28.10.2023 в 18:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Черниш Оксана Сергіївна
19.10.2022 в 21:51
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тодоров Леонід
31.10.2021 в 20:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
27.10.2021 в 07:49
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мыща Светлана
11.11.2020 в 20:35
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Труш Олена Олександрівна
27.10.2020 в 16:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лисенко Надія Ол.
04.10.2020 в 20:06
Загальна:
4.0
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
4.0
Показати ще 8 відгуків