Презентація до уроку: "Закон Авогадро. Молярний об'єм газів"
Про матеріал
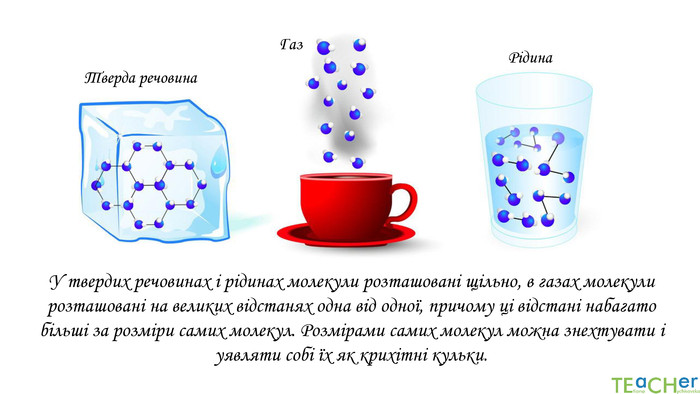
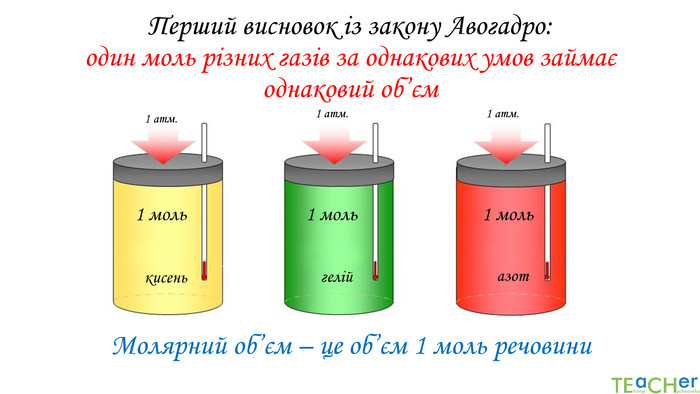
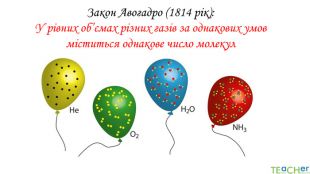
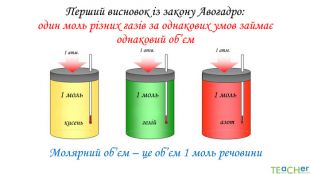
У презентації подано матеріал про закон Авогадро, молярний об'єм газів, розглядаються типові задачі. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку




























-

Потапова Галина Іванівна
03.12.2024 в 20:25
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайленко Лидия
28.11.2024 в 17:12
Дякую за Вашу роботу
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Котік Тетяна Юріївна
23.01.2024 в 03:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Юсин Надія Улянівна
15.01.2024 в 17:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мыща Светлана
25.12.2023 в 16:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Онишко Ольга Олександрівна
14.12.2023 в 00:01
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тимчишин Іванна
09.12.2023 в 17:23
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сільчук Олена Миколаївна
26.11.2023 в 18:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бурдейна Вікторія
06.08.2023 в 20:06
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Афанасенко Элеонора
04.02.2023 в 19:35
Презентації просто чудові! Все структуровано і зрозуміло. Дуже дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
12.01.2023 в 20:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
11.01.2023 в 22:02
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Удовиченко Оксана Дмитрівна
10.01.2023 в 18:28
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Воронівська Наталья Гуріївна
14.12.2022 в 13:34
Дуже дякую!!! Ваші розробки завжди використовую у своїй роботі .
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Клюй Татьяна
01.12.2022 в 15:07
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Таран Тетяна
01.12.2022 в 15:04
Ваші презентації чудові. Дуже дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Парфілко Ольга Анатоліївна
07.02.2022 в 02:56
Дякую!! Дуже подобаються Ваші розробки. Завжди їх використовую у своїй роботі.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дзевенко Марія Віталіївна
03.02.2022 в 10:37
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Чепак Галина Олександрівна
26.01.2022 в 19:17
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Раєва Алла Фахраддинівна
14.01.2022 в 12:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Маначинська Оксана
30.03.2021 в 21:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бойченко Наталія Костянтинівна
27.01.2021 в 19:48
Щиро - дяую за Вашу роботу! Просто - супер!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Радченко Тетяна Василівна
20.01.2021 в 20:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Більченко Олена Олегівна
19.01.2021 в 08:02
Браво! Чудова робота!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
18.01.2021 в 16:16
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 22 відгука