Презентація: "Електролічна дисоціація"
Про матеріал
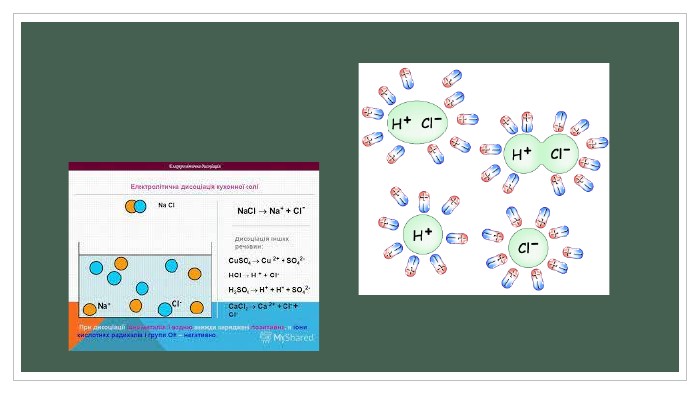
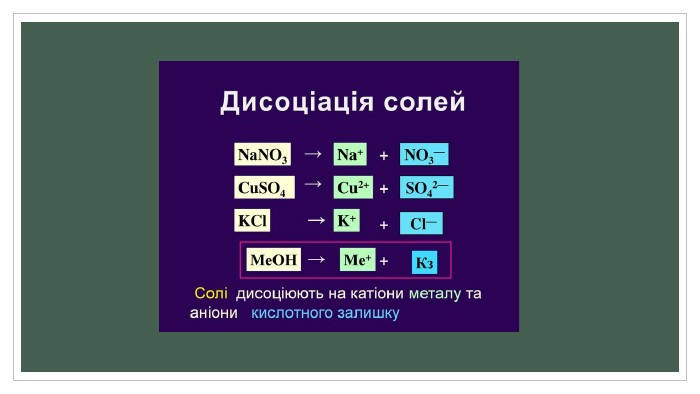
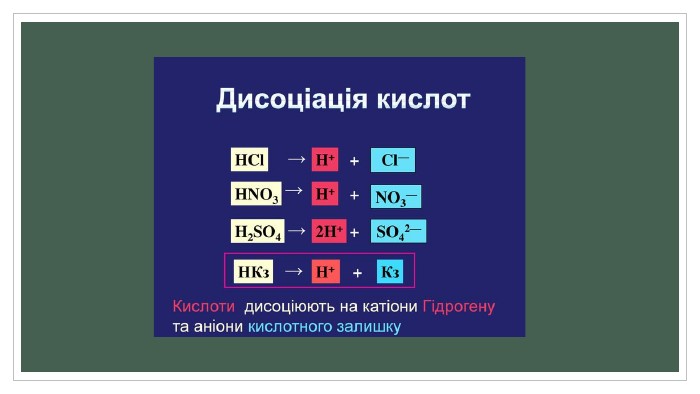
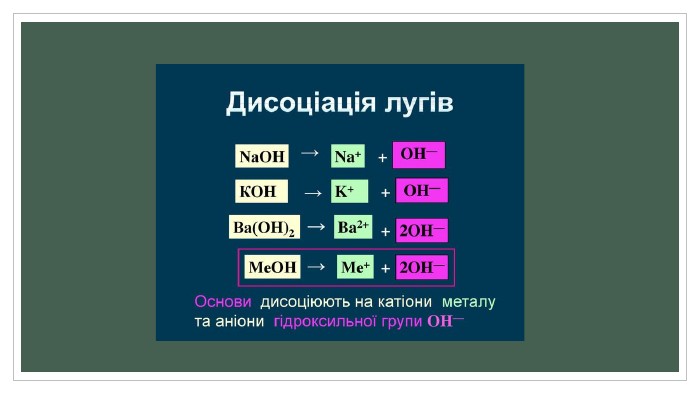
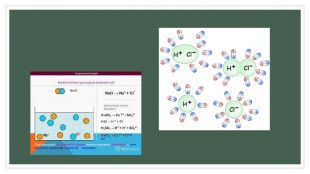
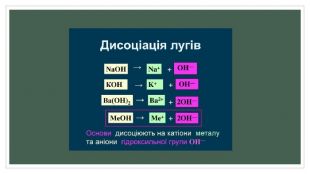
Полярні розчинники ослаблюють електростатичну взаємодію між зарядженими складовими молекули, зв'язок між якими має іонний характер. Ослаблення взаємодії з макроскопічної точки зору зумовлене великою діелектричною проникністю розчинника. Наприклад, для води діелектрична проникність дорівнює 81, тому вода такий гарний розчинник. З мікроскопічної точки зору, молекули полярного розчинника — диполі, що орієнтуються поряд із молекулою розчиненої речовини таким чином, щоб кулонівська сила їхнього притягання протидіяла кулонівським силам іонного зв'язку. Як наслідок, молекула розчиненої речовини розпадається на іони, які можуть існувати в електроліті завдяки екрануванню створеного ними електростатичного поля.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку