Презентація: "Необоротні і оборотні реакції"
Про матеріал
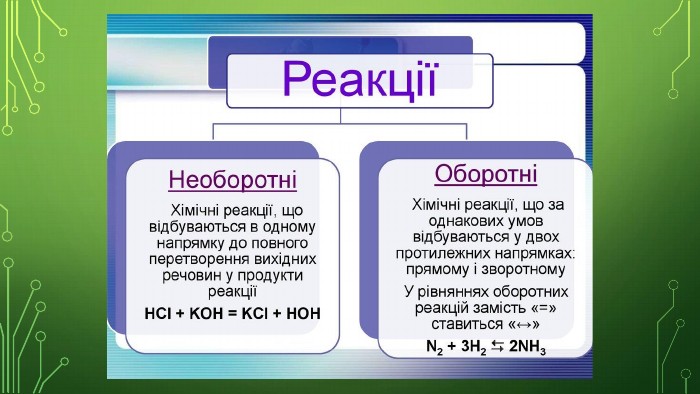
Принцип Ле Шательє. Чи можна зрушити хімічну рівновагу? Адже виробництво сульфатної кислоти, амоніаку, багатьох інших неорганічних і органічних речовин пов’язане з оборотними процесами. Якщо не керувати ними ззовні, неможливо буде отримати цільовий продукт хімічного виробництва. Ви вже знаєте, що на швидкість хімічних реакцій упливають уміст реагентів, температура та (для газуватих речовин) тиск. Тобто, змінивши ці умови, можна пришвидшувати чи уповільнювати як пряму, так і обернену реакції.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку