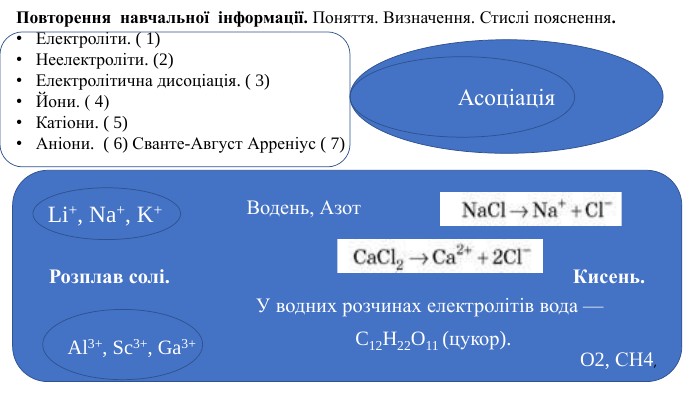
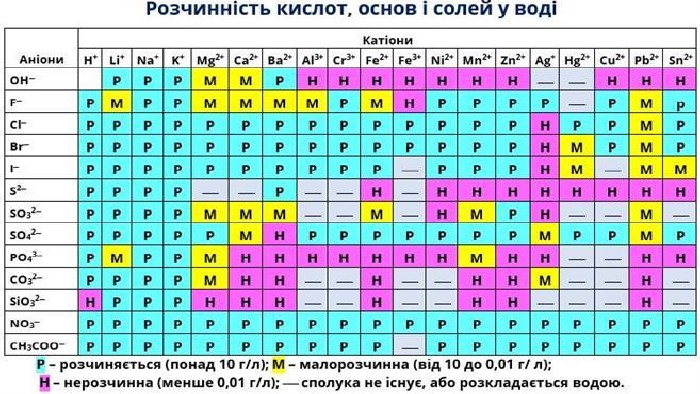
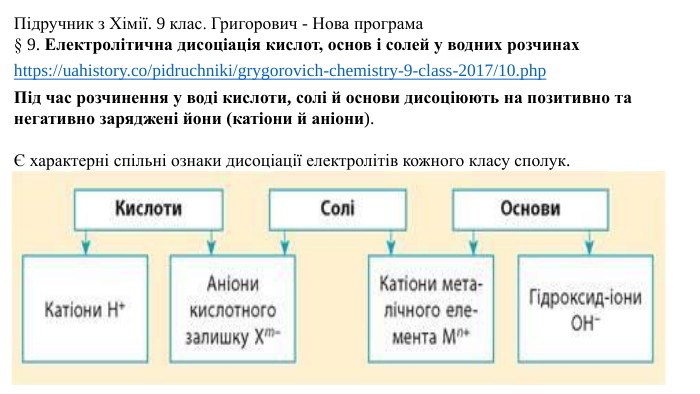
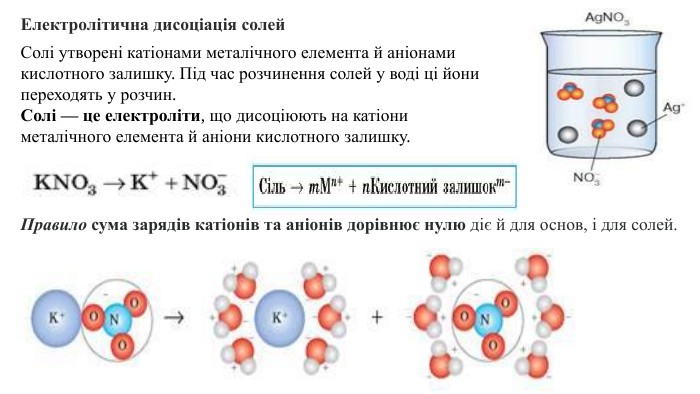
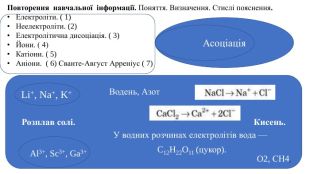
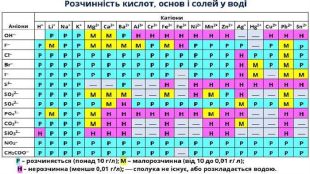
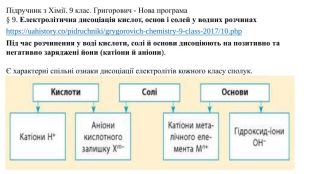
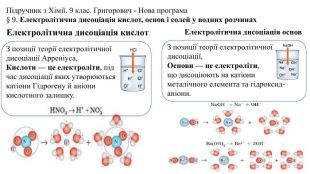
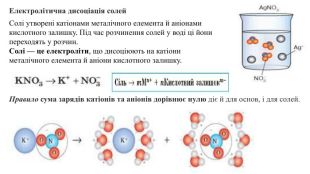
Презентація "Електролітична дисоціація кислот, основ і солей у водних розчинах."
Про матеріал
Пропоную до уваги добірку навчального матеріала у вигляді презентації. Презентація за темою "Електролітична дисоціація кислот, основ і солей у водних розчинах." може бути корисною та використана під час підготовки до уроку або під час уроку онлайн або офлайн заняття. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую!
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку