Презентація "Ферум як представник металічних елементів побічних підгруп. Фізичні та хімічні властивості сполук Феруму (ІІ) і Феруму (ІІІ)"
Про матеріал
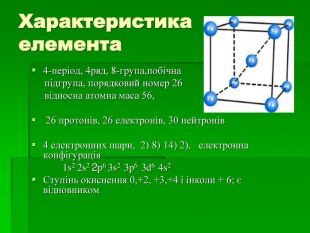
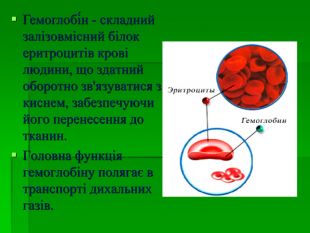
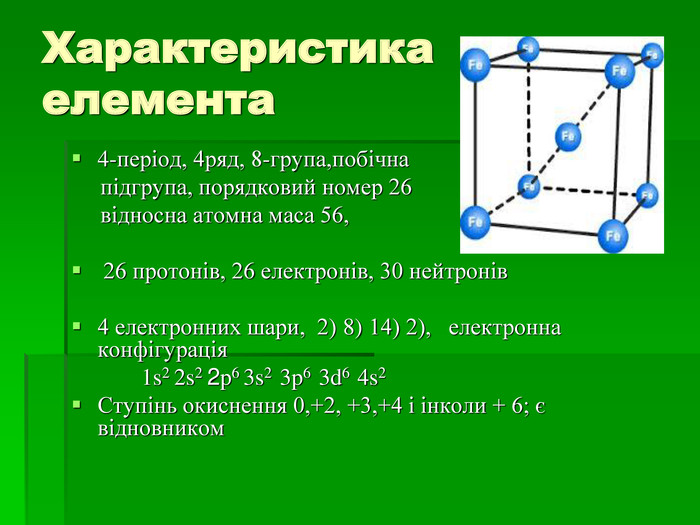
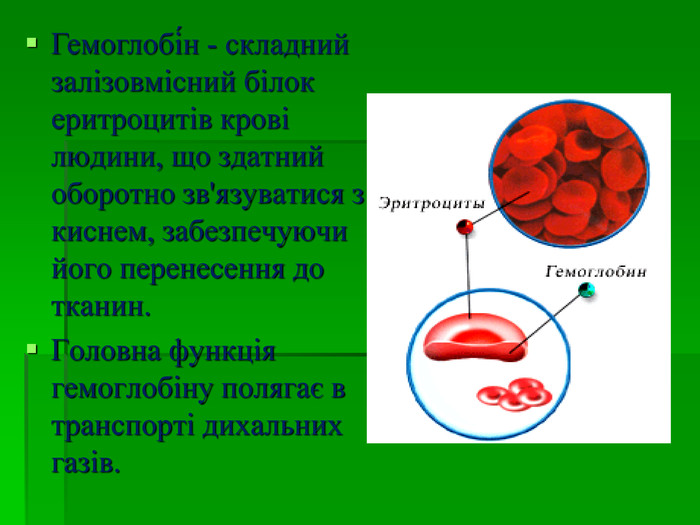
В презентації розглянуто будову атому Феруму, фізичні та хімічні властивості, природні сполуки Феруму якісні реакції на йони Fe2+, Fe3+, розглянуто значення заліза в житті людини.
Перегляд файлу
Зміст слайдів
ppt
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






















![Якісна реакція на катіони Феруму Fe 2+ K3[Fe(CN)6]—червона кров'яна сіль утворюється темно-синій осад турнбулева синь Fe3[Fe(CN)6]2 Якісна реакція на катіони Феруму Fe 2+ K3[Fe(CN)6]—червона кров'яна сіль утворюється темно-синій осад турнбулева синь Fe3[Fe(CN)6]2](/uploads/files/127233/32243/32210_images/25.jpg)
![Якісна реакція на катіони Феруму Fe 3+ K4[Fe(CN)6]– жовта кров'яна сіль утворюється темно-синій осад берлінська блакить Fe4[Fe(CN)6]3 NH4SCN – роданід амонію, утворюється роданід феруму кроваво-червоного кольору Fe(SCN)3 Якісна реакція на катіони Феруму Fe 3+ K4[Fe(CN)6]– жовта кров'яна сіль утворюється темно-синій осад берлінська блакить Fe4[Fe(CN)6]3 NH4SCN – роданід амонію, утворюється роданід феруму кроваво-червоного кольору Fe(SCN)3](/uploads/files/127233/32243/32210_images/26.jpg)