Презентація "Фізичні властивості та алотропія Карбону, Сульфуру та Фосфору"
Про матеріал
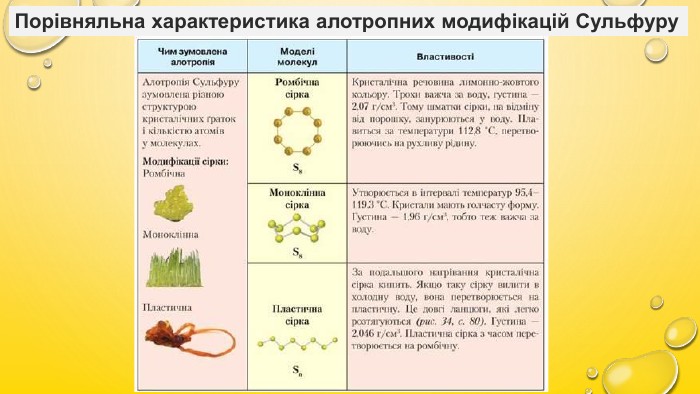
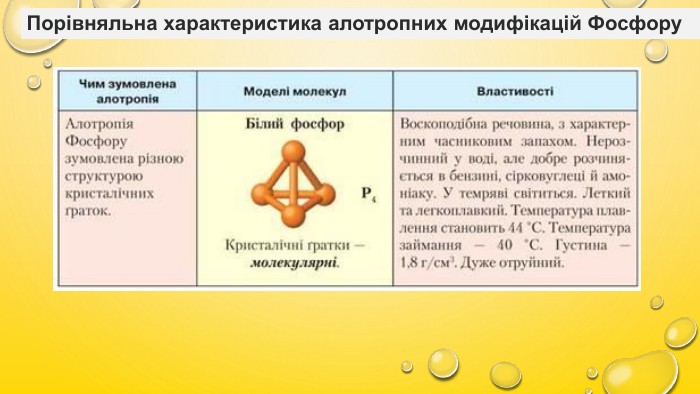
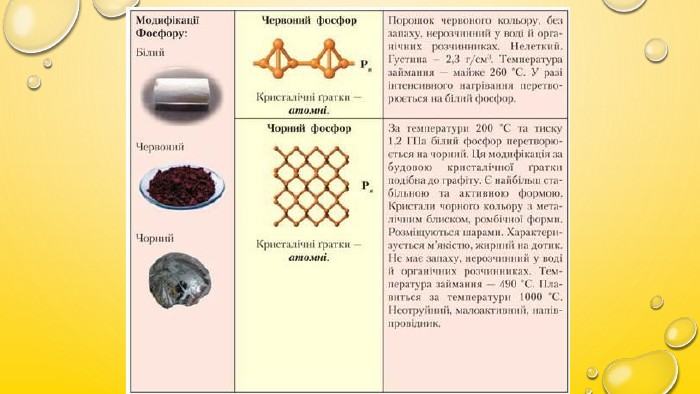
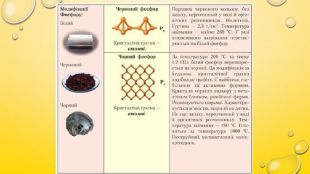
Алотропія, Алотропні модифікації Карбону, Сульфуру та Фосфору. Порівняльна характеристика даних речовин, фізичні властивості Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку