Презентація «Характеристика елемента» 8 клас
Про матеріал
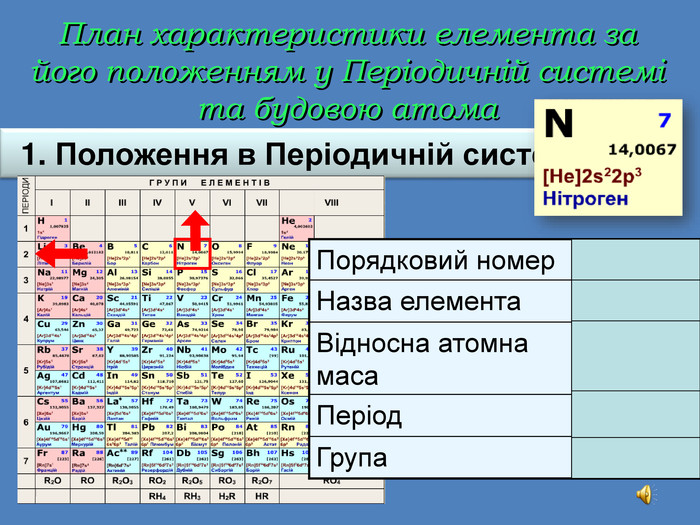
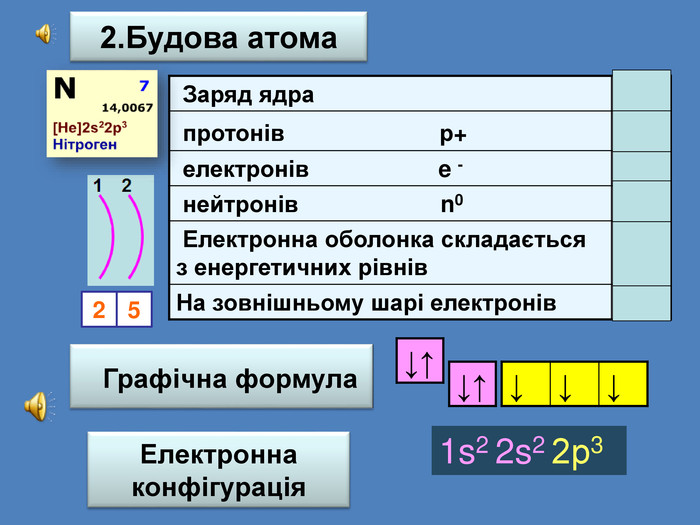
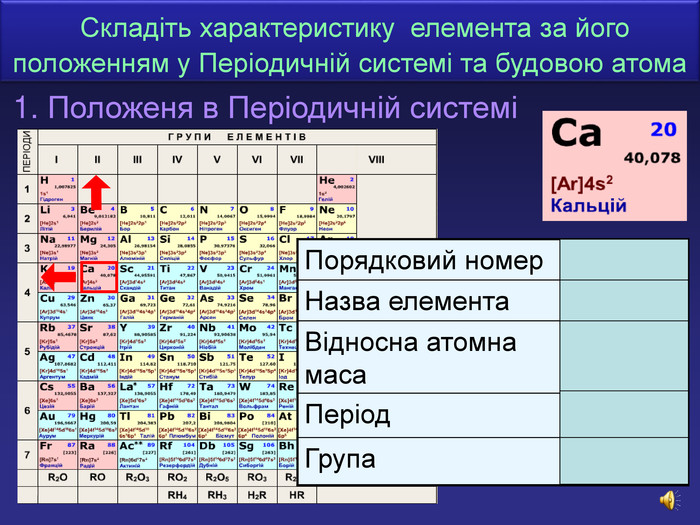
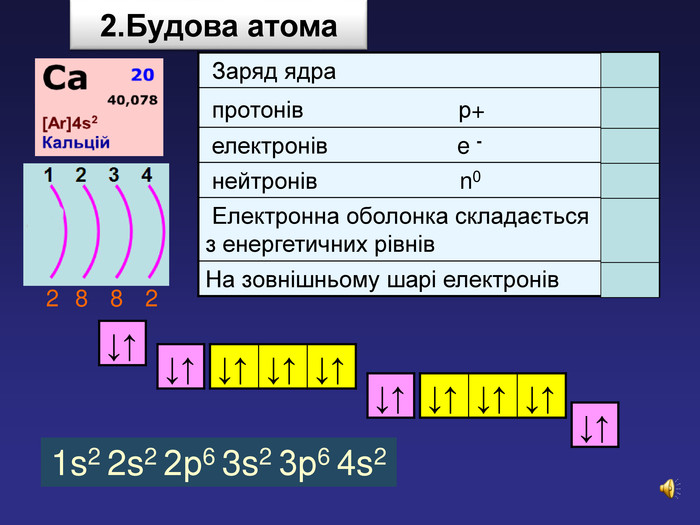
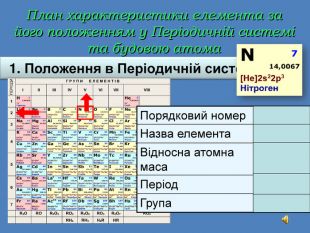
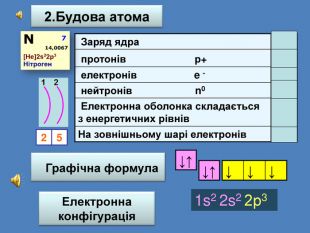
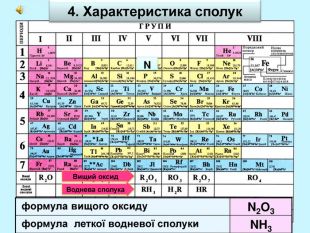
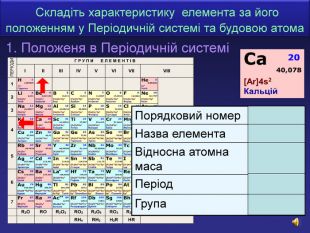
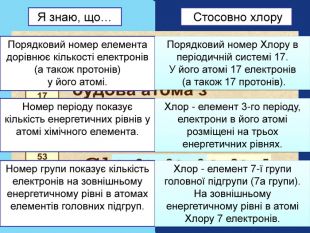
| Презентація допоможе учням та вчителю при проведенні уроку на тему «Характеристика хімічних елементів № 1-20 за їхнім місцем у періодичній системі та будовою атома» |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Дякую, у Вас надзвичайні презентації
-
-
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку