Презентація «Хімічні формули» 7 клас
| Валентність хімічних елементів. Складання формул бінарних сполук за валентністю елементів. Визначення валентності елементів за формулами бінарних сполук |


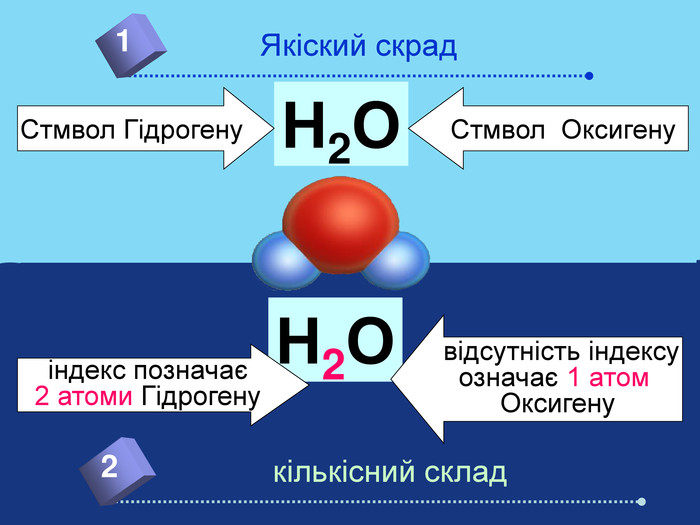



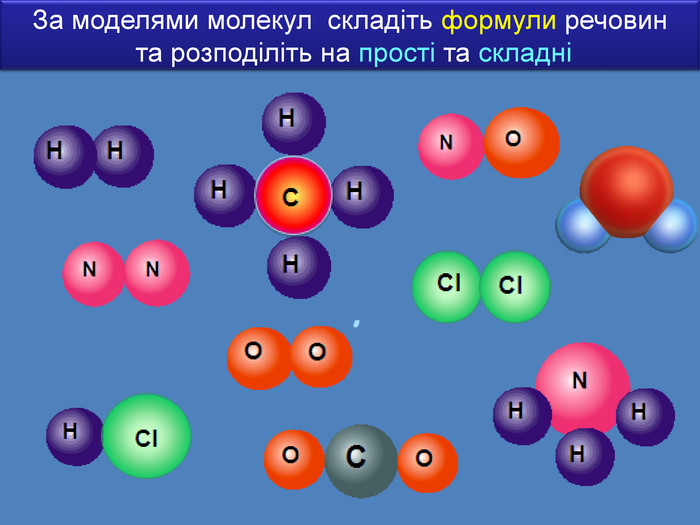
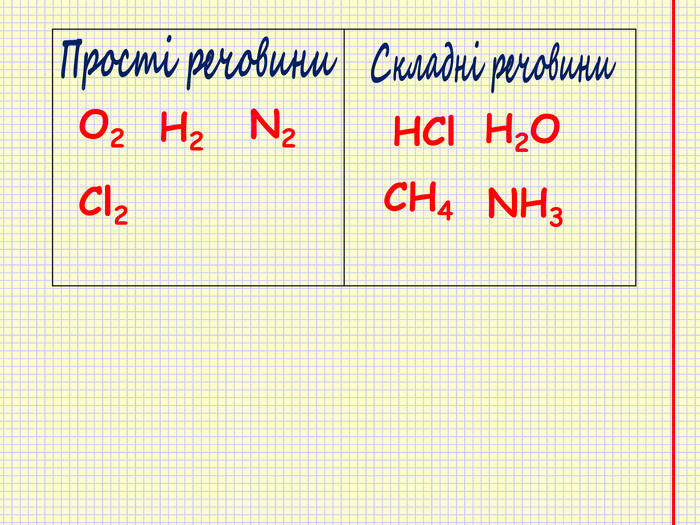



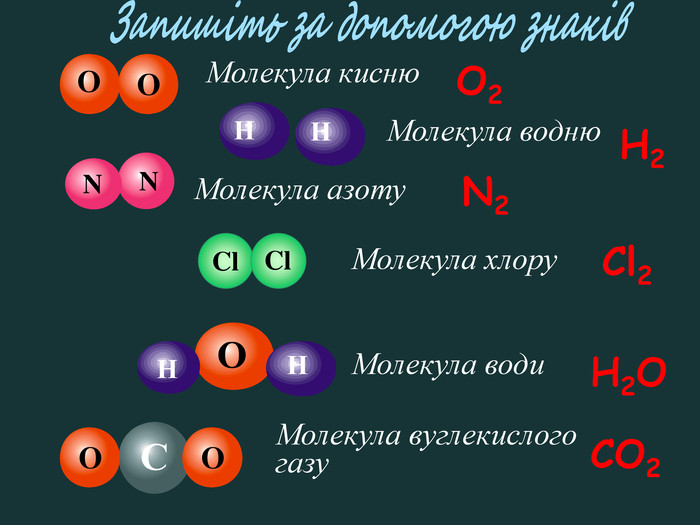



















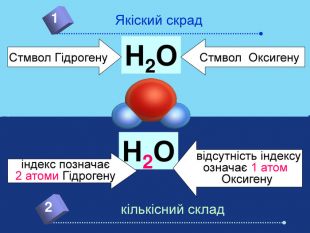
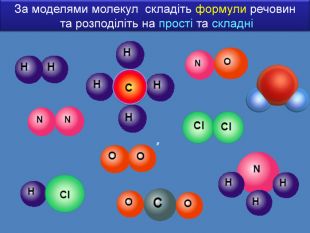
Якщо атоми умовно уявити у вигляді маленьких кульок, то молекули матимуть вигляд набору різних кульок певної форми та розмірів. Наприклад: молекула кисню складається з двох атомів Оксигену О ОЗа допомогою хімічних знаків записують. О2 Наприклад: молекула води складається з двох атомів Гідрогену та одного атома Оксигену ОННЗа допомогою хімічних знаків записують. Н2 О
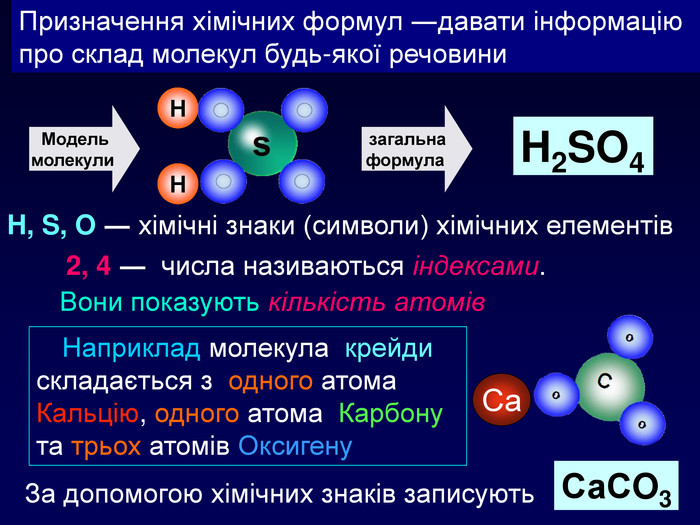
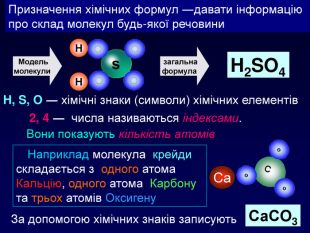
Призначення хімічних формул ―давати інформацію про склад молекул будь-якої речовини. Модель молекули ННзагальна формула H2 SO4 H, S, O ― хімічні знаки (символи) хімічних елементів 2, 4 ― числа називаються індексами. Вони показують кількість атомів Наприклад молекула крейди складається з одного атома Кальцію, одного атома Карбону та трьох атомів Оксигену. Са. За допомогою хімічних знаків записують. Са. СO3
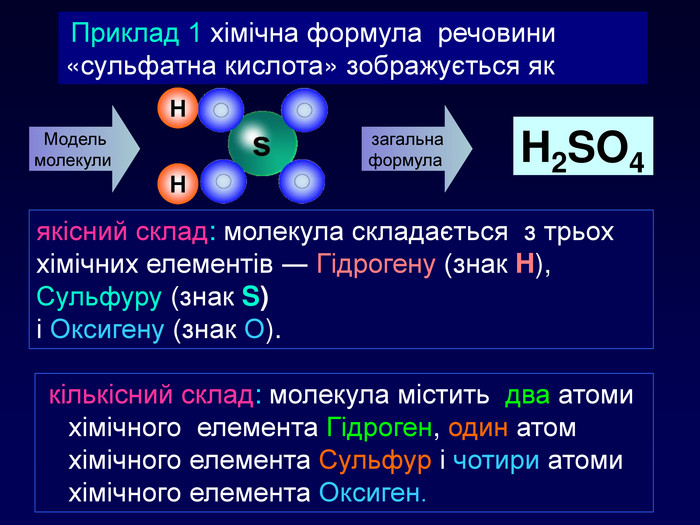
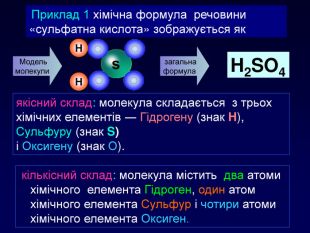
Приклад 1 хімічна формула речовини «сульфатна кислота» зображується як. Модель молекули ННзагальна формула H2 SO4 Визначіть якісний склад молекулаиякісний склад: молекула складається з трьох хімічних елементів ― Гідрогену (знак H), Сульфуру (знак S) і Оксигену (знак О). Визначіть кількісний склад молекулаи кількісний склад: молекула містить два атоми хімічного елемента Гідроген, один атом хімічного елемента Сульфур і чотири атоми хімічного елемента Оксиген.
Приклад 2 хімічна формула речовини «озон» зображується як. О3якісний склад: молекула складається з одного хімічного елементіа ― Оксигену (знак О). кількісний склад: молекула містить три атоми хімічного елемента Оксигену. Приклад 3 хімічна формула речовини «неон» зображується як. Neякісний склад: молекула складається з одного хімічного елементіа ― Неону . Індек 1 не пишеться.
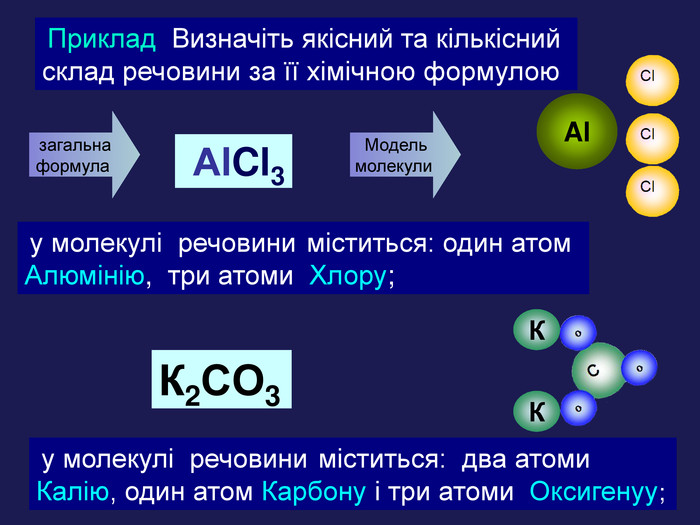
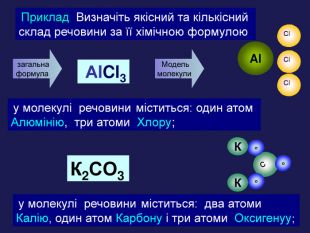
загальна формула Аl. Cl3 Al. Модель молекули у молекулі речовини міститься: один атом Алюмінію, три атоми Хлору; К2 СO3 КК у молекулі речовини міститься: два атоми Калію, один атом Карбону і три атоми Оксигенуу; Приклад Визначіть якісний та кількісний склад речовини за її хімічною формулою
О2 Молекула кисаню складається з двох атомів Оксигену Вправи в застосуванні знань Запишіть її за допомогою хімічних знаків та індексів. Fе. SМолекула речовини складається з одного атома Феруму та одного атома Сульфуру Запишіть її за допомогою хімічних знаків та індексів. Fе. S Ферум-ес
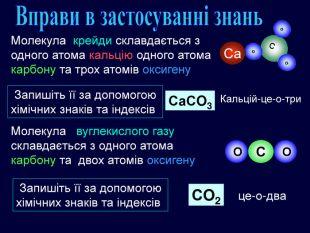
Са. Са. СO3 Молекула крейди склавдається з одного атома кальцію одного атома карбону та трох атомів оксигену Запишіть її за допомогою хімічних знаків та індексів. Кальцій-це-о-три СO2 Молекула вуглекислого газу склавдається з одного атома карбону та двох атомів оксигену С О О Запишіть її за допомогою хімічних знаків та індексів. Вправи в застосуванні знаньце-о-два
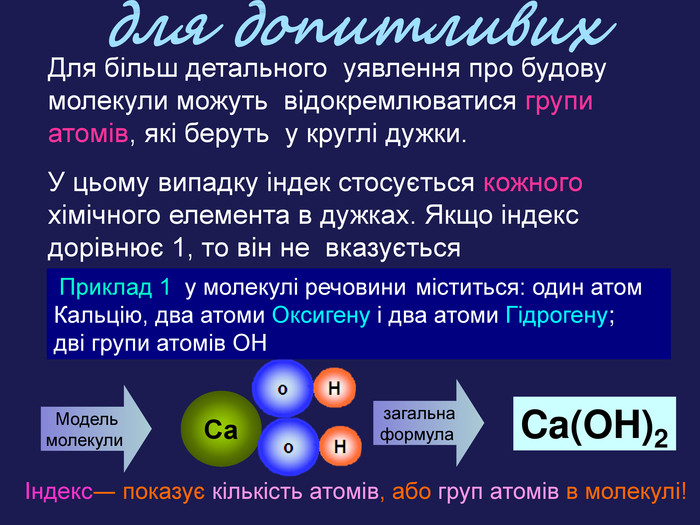
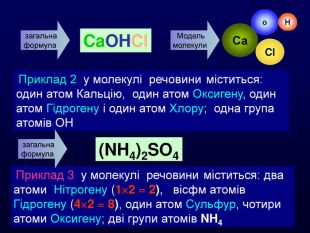
Для більш детального уявлення про будову молекули можуть відокремлюватися групи атомів, які беруть у круглі дужки. У цьому випадку індек стосується кожного хімічного елемента в дужках. Якщо індекс дорівнює 1, то він не вказується Приклад 1 у молекулі речовини міститься: один атом Кальцію, два атоми Оксигену і два атоми Гідрогену; дві групи атомів ОН Модель молекули Сaзагальна формула Ca(OH)2Індекс― показує кількість атомів, або груп атомів в молекулі! для допитливих
Часто до складу речовин входчяь групи атомів, які повторюються кілька разів. Для зручності у формулах ці групи записуються в дужках; кількість груп указується індексом за дужками. Приклад формула речовини, яка складається з одного атома Карбону, одного атома Оксигену й двох груп, записужєтьсься так: CО(NH2)2 NH2Індекс за дужками стосується всіх атомів, взятих у дужки, тобто крім одного атома Карбону, одного атома Оксигену в молекулі речовини міститься два атоми Нітрогену, чотири атоми Гідрогену. СОNNHHHH
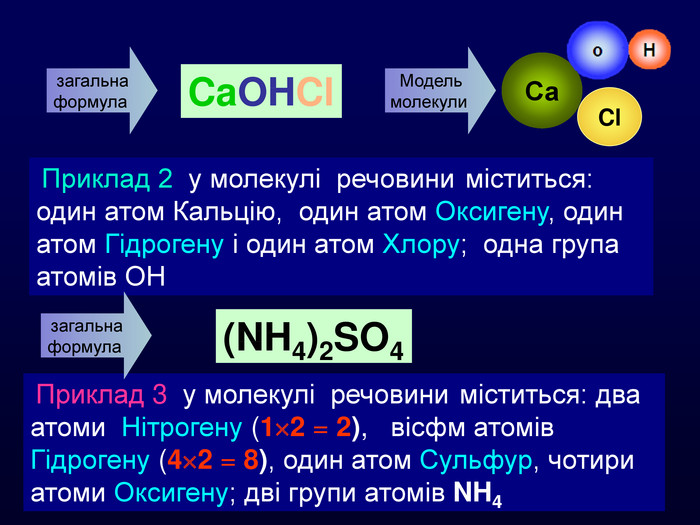
Приклад 2 у молекулі речовини міститься: один атом Кальцію, один атом Оксигену, один атом Гідрогену і один атом Хлору; одна група атомів ОН Модель молекули Сa. Ca. OHClзагальна формула Приклад 3 у молекулі речовини міститься: два атоми Нітрогену (12 = 2), вісфм атомів Гідрогену (42 = 8), один атом Сульфур, чотири атоми Оксигену; дві групи атомів NH4 загальна формула (NH4)2 SO4 Cl
Для позначення кількох молекул використовують число, що ставиться перед хімічною формулою речовини. Це число називається коефіцієнт. У пятьох молекулах води містяться 10 атомів Гідрогену (52 = 10) та пять атомів Оксигену (51 = 5)5 H2 O Приклад 1 Для позначення пяти молекул води використовують запис 5 H2 O.
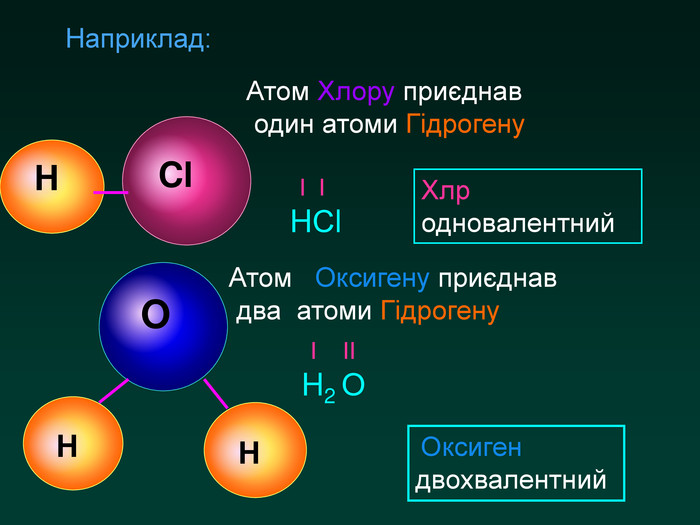
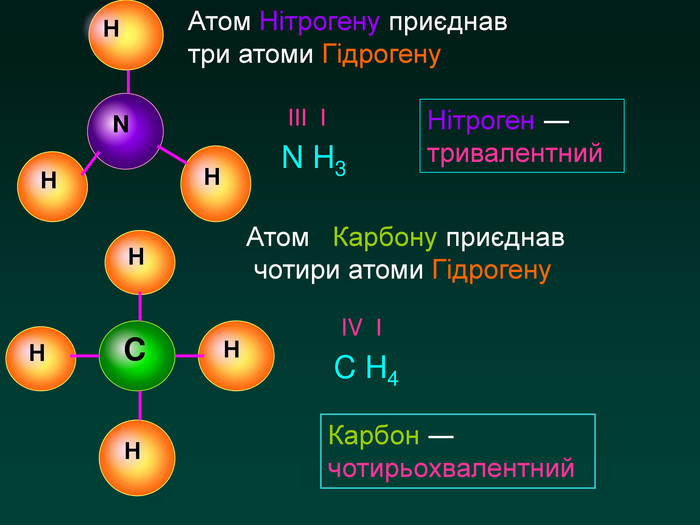
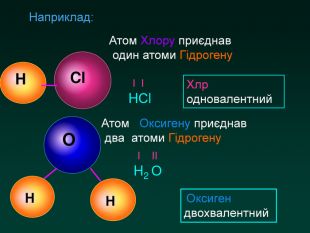
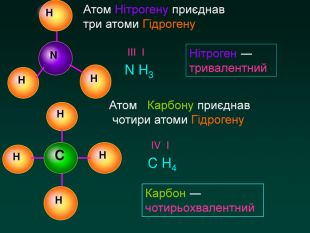
Валентність Здатність атомів хімічно взаємодіяти один з одним називається валентність. За одиницю валентності прийнята валентність атома Гідрогену. Вона дорівнює 1 Вважають, що Гідроген у сполуках одовалентний. За кількістю атомів Гідрогену, що може приєднати атом, можна визначити його валентність
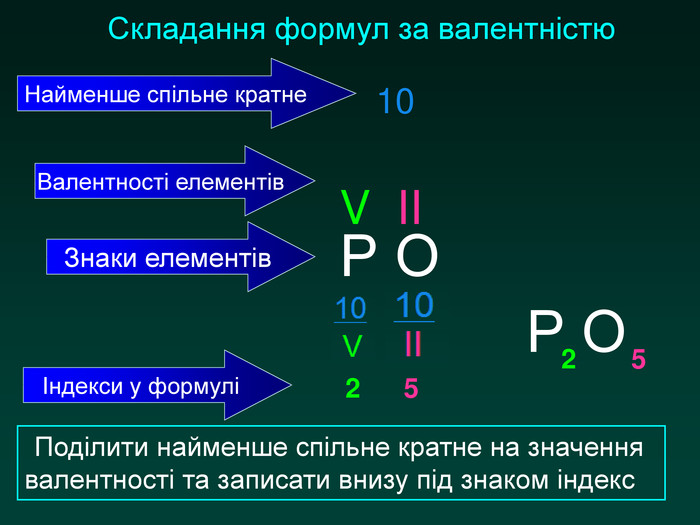
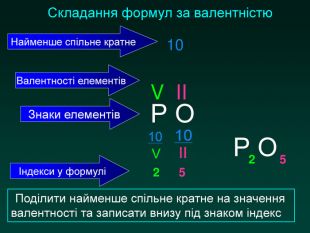
Складання формул за валентністю. Послідовнвсть дій Виконання дій Записати хімічні символи елементів. Р О Знайти найменше спільне кратне для значень валентностей та записати Р ОV IIНад відповідними символами позначити римськими цифрами валентність. Р ОV II10 Поділити найменше спільне кратне на значення валентності та записати внизупід знаком індекс Р2 О510 : 5 = 210 : 2 = 5
Для атомів елементів зі змінною валентністю валентність указується в дужках поряд з назвою або хімічним символом елемента. Карбон (IV); Ферум (III); S (VI); P (V); N (IV); Валентність можна розрахувати за валентністю атома з відомою валентністю в бінарних сполуках P2 O5ІІ ?Помножити відому валентність на кількість атомів 2 5 = 10 Поділити добуток на кількість атомів елемента, валентність якого шукаємо 10 : 2 = 5 Поставитивалентність над знаком римськими цифрами V V
П. П. Попель, Л,С. Крикля Хімія. Підручник для 7 кл. Київ. Видавничий центр “Академія”, 2016 Григорович О. В. Хімія.7 клас Розробки уроків Х.: Вид-во “Ранок”, 2007. Шаповалов С. А. Довідник старшокласниката абітурієнта. Х. Торсінг, 2005. Старовойтова І. Ю. Усі уроки хімії. 7 клас. Х.: Вид. група “Основа”, 2007. Хімія. Практичний довідник 7-9 клас. / Авт.-упорядник Курмакова І. М. та інші – Чернігів: КММЕДІА, 2015.


про публікацію авторської розробки
Додати розробку





























-

Шубіна Вікторія Вікторівна
01.04.2024 в 20:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайлюк Галина
21.11.2022 в 19:54
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Клочкова Ольга Анатоліївна
07.11.2022 в 00:18
дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кузаконь Тетяна Петрівна
24.10.2022 в 18:40
Дякую!!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Городечна Алла Марківна
14.11.2021 в 12:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Вороніна Наталя Павлівна
01.11.2020 в 20:11
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Михайленко Лариса Анатоліївна
12.11.2019 в 20:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
12.04.2018 в 12:34
+++
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 5 відгуків