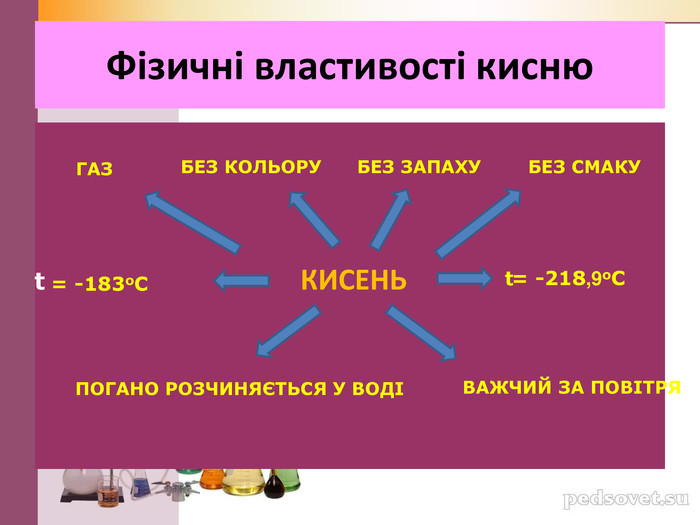
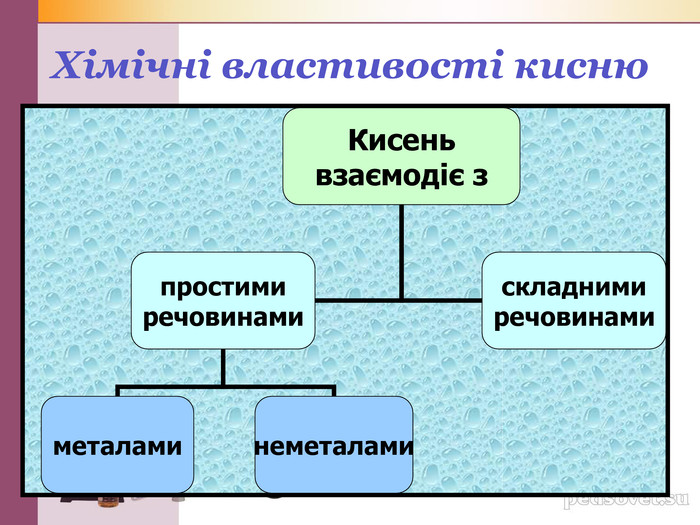
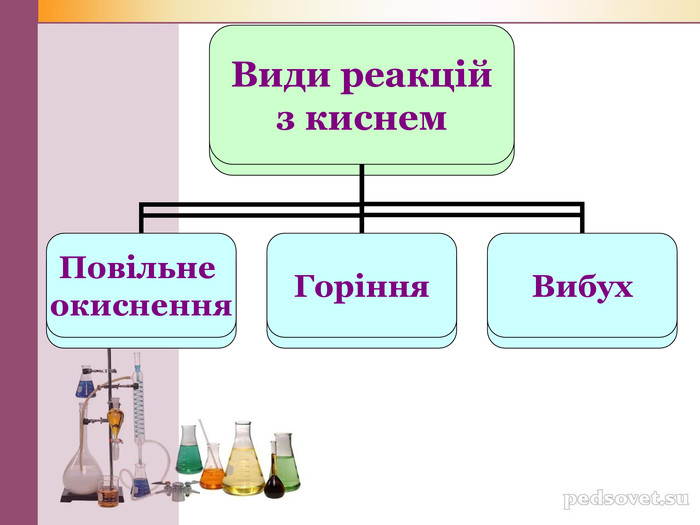
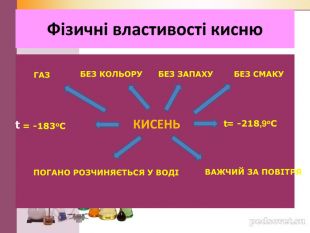
Презентація"Хімічні властивості кисню"
Про матеріал
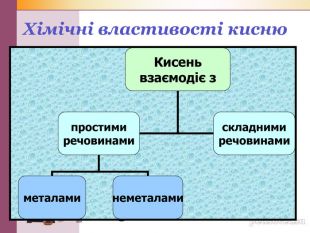
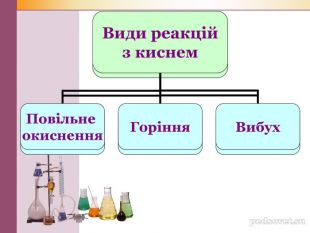
Презентація"Хімічні властивості кисню"
Архів який містить в собі презентацію та відеоматеріали до неї(досліди).
Зміст архіву
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку