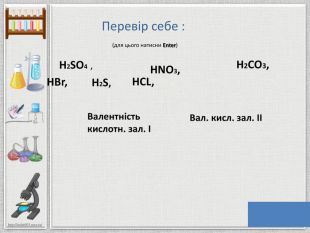
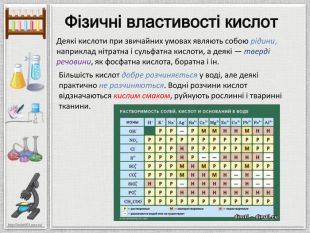
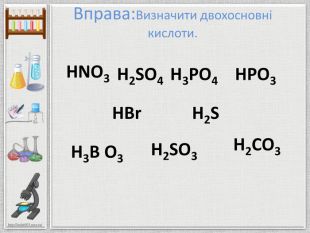
Презентація:"Кислоти"
Про матеріал
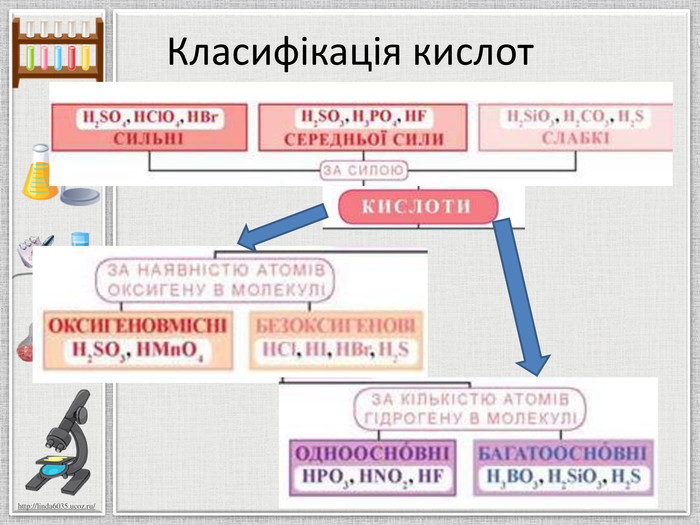
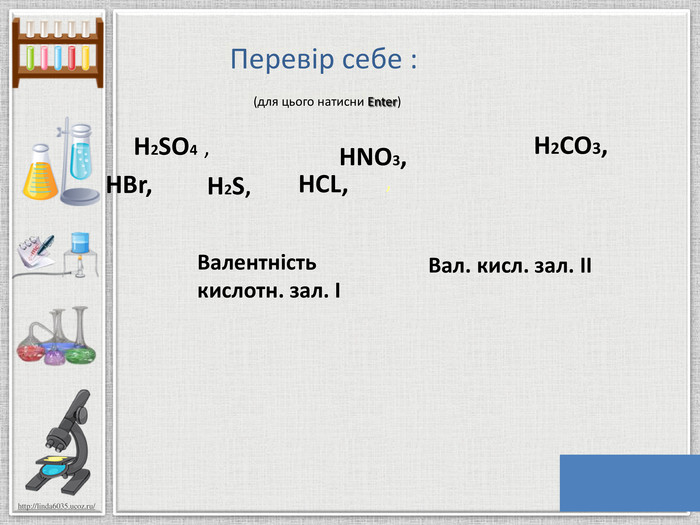
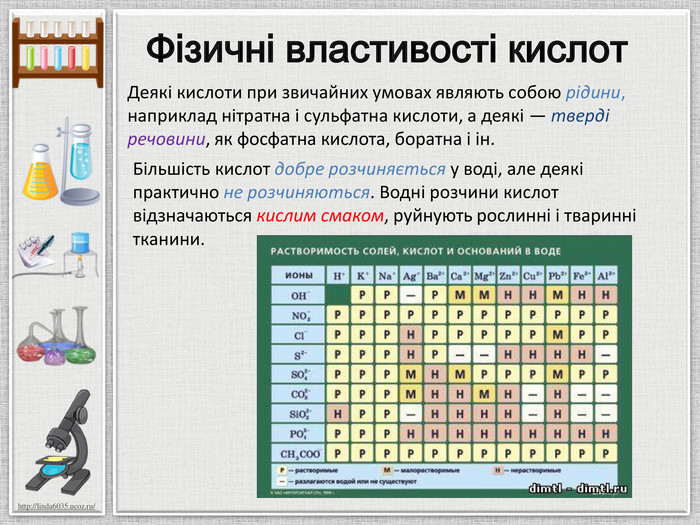
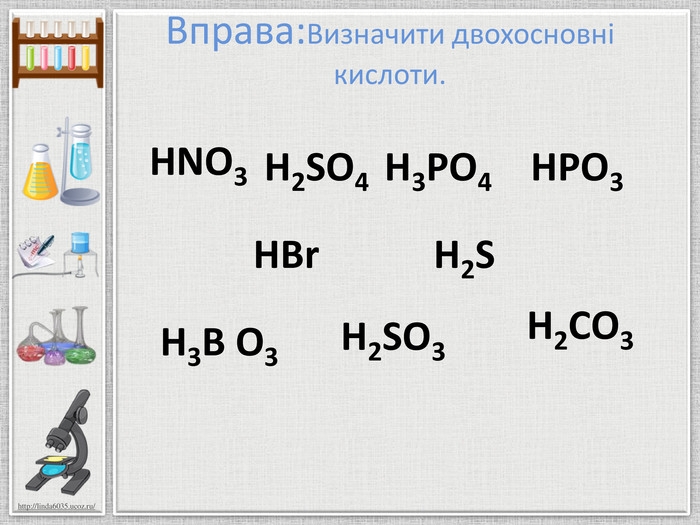
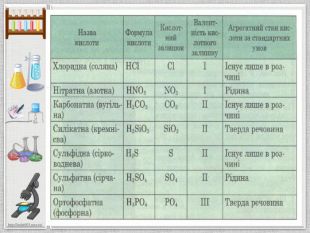
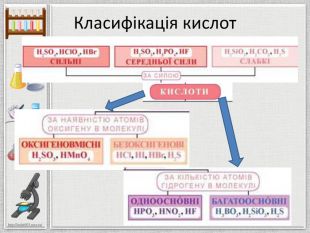
Мета презентації: ознайомлення з поняттям «Кислоти», класифікацією кислот, фізичними властивостями та реакціями заміщення. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку