Урок хімії 8 клас на тему "Ковалентний полярний та неполярний зв"язок".
УРОК ХІМІЇ
8 клас
на тему:
«Ковалентний зв’язок, його утворення. Полярний і неполярний ковалентний зв’язок».
Тема Ковалентний зв'язок, його утворення. Полярний і неполярний ковалентний зв’язок.
Цілі:
- Формування ключових компетентностей:
- саморозвитку й самоосвіти – створення проблемних ситуацій;
- інформаційноївміння робити короткий раціональний запис, робити висновки та узагальнення.
- Формування предметних компетентностей: дати поняття ковалентного зв'язку, з'ясувати механізм утворення ковалентного зв'язку, його види, дати поняття «диполь», розвивати поняття «електронегативність»; набути навичок складання електронних і структурних формул будови молекул; виховувати вміння виділяти головне, актуалізувати, конспектувати, порівнювати, зіставляти.
Тип уроку: засвоєння нових знань.
Обладнання: таблиця «Схеми утворення ковалентного зв’язку».
Девіз: “Необхідно, щоб той, хто що – не будь уміє, навчав цього інших, які мають у цьому потребу.”
Альбрехт Дюрер
Хід уроку
І. Організаційний момент
Привітання, психологічний настрій учнів. Перевірка домашнього завдання. Повідомлення теми та мети уроку.
ІІ. Актуалізація опорних знань учнів
Фронтальне опитування
1. Що таке електронегативність?
2. Чи залежить електронегативність елемента від електронної структури атома ? Наведіть приклади.
3. Як змінюється електронегативність елементів у періодах, групах?
4. Які можливі випадки об’єднання елементів з різним значенням електронегативності?
5. Використовуючи Періодичну систему Д. І. Менделєєва, наведіть по два приклади речовин з різним типом зв’язку між атомами.
ІІІ. Зіткнення учнів із проблемою й висловлення первинних гіпотез
Чому молекули благородних газів одноатомні, а молекули інших газів — простих речовин — двохатомні? Як утворюються хімічні зв’язки? На ці питання ми повинні знайти відповіді на уроці.
- Що таке ковалентний зв'язок?
- Механізм утворення ковалентного зв’язку на прикладі молекул хлору та кисню.
- Сформулювати основні властивості ковалентного неполярного зв’язку.
- Виявити залежність властивостей речовин від типу хімічного зв’язку.
ІV. Робота над гіпотезами, висловленими учнями
Ковалентний зв'язок
Вчитель. Подивіться на таблицю «Схеми утворення ковалентного зв’язку». (На основі схеми дається визначення ковалентного зв’язку). Хімічний зв'язок, який утворюється з допомогою спільних електронних пар, називається ковалентний.
Ковалентний неполярний зв'язок.
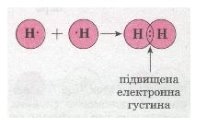
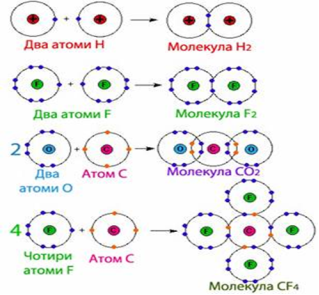
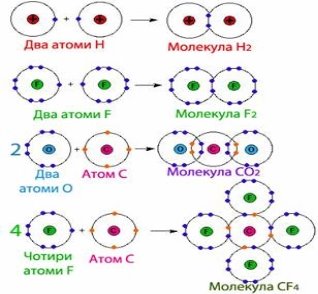
Для прикладу розглянемо утворення молекули водню Н2. Тобі відомо, що кожний атом Гідрогену має в електронній оболонці один s-електрон, а завершеним для нього буде двох електронний рівень, подібний завершеному рівню атома Гелію. У разі зближення двох атомів Гідрогену за рахунок сил притягання, що діють між їхніми ядрами та електронами, s-електронні хмари сферичної форми обох атомів частково перекриваються. У місці перекривання виникає підвищена електронна густина, яка притягує до себе ядра обох атомів і забезпечує міцність їхнього сполучення в молекулу.
Якщо неспарений валентний електрон позначити точкою, а спільну електронну пару — двома точками, то можна записати схему утворення хімічного зв'язку між атомами Гідрогену в молекулі водню:
Мал. 1. Схема утворення хімічного зв'язку між атомами.
Якщо позначити спільну електронну пару рискою, то запис називають структурною формулою водню: Н—Н.
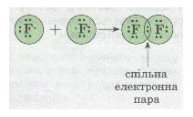
Розглянемо ще один приклад утворення ковалентного зв'язку в молекулі фтору F2. Кожний атом Флуору (елемент VII групи) має 7 валентних електронів, з них — один р-електрон не спарений. У разі зближення двох атомів Флуору відбувається перекривання хмар двох неспарених р-електронів, утворюється спільна електронна пара:
Мал. 2. Електронна пара.
У наведеному прикладі зовнішній енергетичний рівень завершується до октету – восьми електронів.
Хімічний зв'язок, який утворюється за допомогою спільних електронних пар, називають ковалентним зв'язком. Слово «ковалентний» означає «спільновалентний»: атоми разом володіють усуспільненими валентними електронами.
У розглянутих випадках спільна електронна пара належить обом атомам однаковою мірою. Такий ковалентний зв'язок називають неполярним. Він виникає під час взаємодії атомів неметалів одного й того самого хімічного елемента, оскільки в них однакова електронегативність. Так, у молекулах Н2, О2, F2, Сl2 існує неполярний ковалентний зв'язок.
Кратність ковалентного зв'язку. Бувають випадки, коли два атоми усуспільнюють кілька пар валентних електронів. У такому разі говорять про кратність ковалентного зв'язку. Якщо між атомами виникла одна спільна електронна пара, то такий ковалентний зв'язок називають одинарним, якщо дві — подвійним, якщо три — потрійним.
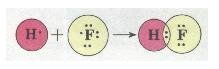
Ковалентний полярний зв'язок. Якщо атоми, що взаємодіють, мають різну електронегативність (атоми різних неметалів), то спільна електронна пара зміщується до атома з більшою електронегативністю. У цьому разі виникає полярний ковалентний зв'язок. Наприклад, у молекулі флуороводню HF зв'язок ковалентний полярний:
Мал. 3. Полярний ковалентний зв'язок.
У результаті зміщення електронної пари в молекулі HF (стрілка показує напрямок зміщення) молекула стає полярною, виникає диполь.
Диполь — це система з двох зарядів, однакових за величиною і протилежних за знаком.
Вважають, що атом, до якого зміщена електронна пара, набуває деякого негативного заряду, а атом, від якого зміщена електронна пара, — деякого позитивного заряду:
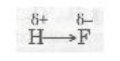 (гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).
(гр. літера δ (дельта) позначає частковий заряд, тобто менший за одиничний).
Полярний ковалентний зв'язок незавжди зумовлює утворення диполя. Наприклад, у разі формування молекули карбон(ІV) оксиду С02електронні пари зміщуються до Оксигену як до більш електронегативного елемента. Але диполь не виникає, бо молекула симетрична.
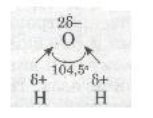
Молекули води Н2О, навпаки, мають кутову будову. Полярні зв'язки О—Н розміщені під кутом 104,5°, що спричинює несиметричність структури і полярність молекул води:
Кутові молекули сірководню H2S, пірамідальні молекули амоніаку NH3 також мають несиметричну структуру, тому вони полярні.
V. Обговорення гіпотез .Загальний висновок
Проведення гри «Назви речовину з певним типом зв’язку» у формі «мікрофон». Учні ставлять один одному питання, використовуючи уявний мікрофон.
Наскрізна змістова лінія Екологічна безпека і сталий розвиток
Робота в парах.
1. Водень є екологічно чистим паливом, так як при його спалюванні з киснем утворюється тільки вода, а водневе полум'я не виділяє в атмосферу продуктів, які забруднюють довкілля. Написати схему утворення молекули водню використовуючи малюнок.
2. Азот застосовують у харчовій промисловості для тривалого і безвідходного зберігання сільськогосподарської продукції, у тому числі насіння і зерна в регульованих газових середовищах; при виробництві олії, жирів; як пакувальний газ при пакуванні продуктів (зареєстрований як харчова добавка E941). Написати схему утворення молекули азоту, використовуючи малюнок
3. Граничний допустимий вміст СО2 в шахтному повітрі 0,5-1 % (за об'ємом). При 10 % наступає непритомність, при 20-25 % — смертельне отруєння. Перша допомога при отруєнні полягає у винесенні потерпілого на свіже повітря, проведенні штучного дихання. Написати схему утворення молекули вуглекислого газу використовуючи малюнок.
4. Відомо, що фторвуглеці (CF4, C2 F6, C3 F8) можуть залишатися в атмосфері понад 50 тис. років — факт, який може бути недооціненим через відсутність природних джерел цих газів. Це означає, що дані сполуки, мають чужерідний потенціал, який сприяє перегріву. Один кілограм гексафториду сірки підсилує парниковий ефект так, як 23 т вуглекислого газу за 100 років. Фторовуглеці подібні щодо цього. Написати схему утворення молекули СF 4 використовуючи малюнок.
VІІ. Підсумки уроку. Оцінювання знань учнів Оцінюються активні учасники навчального процесу.
VІ. Домашнє завдання
Вивчити §15, повторити § 16.
Виконати завдання № 100,101,103*
Вкажіть сполуки з ковалентним неполярним зв'язком: водень, вода, натрій хлорид, хлороводень, азот, метан.
* Написати схему утворення молекули брому.
Список використаних джерел :
1. Хімія.7 - 9 класи – Програма для загальноосвітніх навчальних закладів. Хімія. 7-9 класи (оновлена), затверджена наказом МОН України від 07.06.2017 № 804. (http://mon.gov.ua/activity/education/zagalna-serednya/navchalni-programi-5-9-klas-2017.html)
2. Критерії оцінювання навчальних досягнень учнів у системі загальної середньої освіти,— К.; Ірпінь, 2004,— 176 с.
3. Державний стандарт Постанова Кабінету Міністрів України від 23 листопада 2011 року № 1392 «Про затвердження Державного стандарту базової і повної загальної середньої освіти».
4. Попель, Крикля Хімія: підручник для 8 класу загальноосвітніх навчальних закладів 8 клас 2016
5. Савчин М. М., Ковальчук Н. І. Хімія. Вимірник навчальних досягнень. Діагностично-тренувальні завдання. 9 клас,— Л.: ВНТЛ-Класика, 2004,— 336 с.
6. Ярошенко О. Новицкая В. И. Задания и упражнения по химии: Учебное пособие для средних школ,— К.: Станица, 1997,— 180 с.
8. http://www.nanoworld.org.ru


про публікацію авторської розробки
Додати розробку