Презентація "Кислоти. Класифікація. Хімічні властивості кислот".
Про матеріал
Презентація до уроку з теми: "Кислоти. Класифікація. Хімічні властивості кислот". Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку


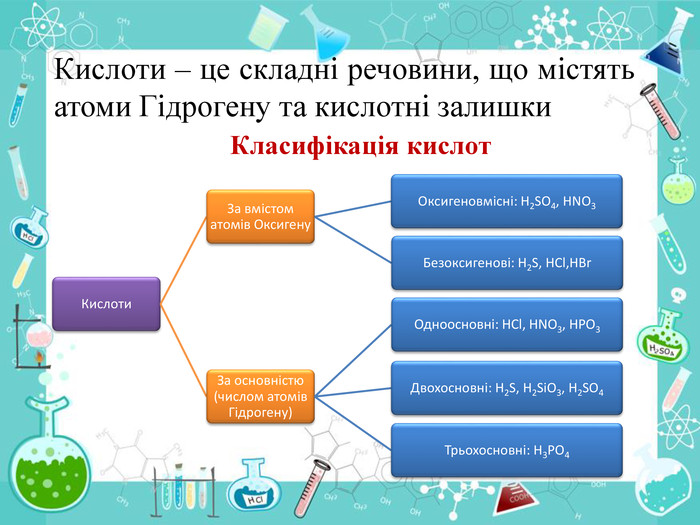























-

Остаповець Юрій
13.02.2023 в 09:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Проценко Ніна Іванівна
11.09.2022 в 15:01
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
4.0
-

Підкалюк Любов Петрівна
24.03.2022 в 07:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шпаргала Ольга Богданівна
17.03.2022 в 20:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дячук Наталія Миколаївна
15.03.2022 в 12:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Ivanenko Olena
09.02.2022 в 08:07
Щиро дякую. Дуже вдала презентація.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
02.02.2022 в 18:05
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мітіна Світлана Миколаївна
07.04.2021 в 15:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Іващенко Наталія Василівна
16.03.2021 в 14:30
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків