Презентація "Класифікація хімічних реакцій"
Про матеріал
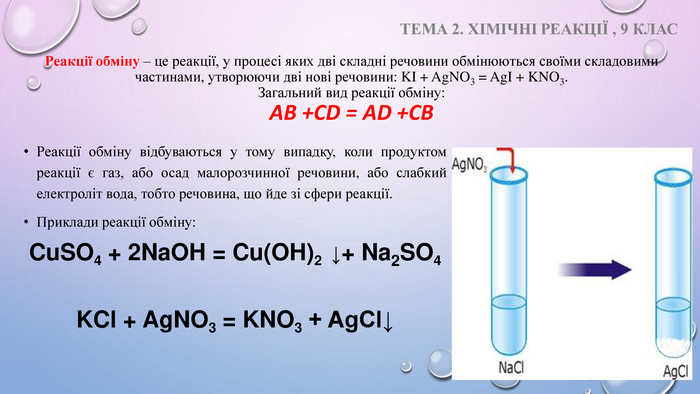
Презентація до уроку 9 клас "Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції: реакції сполучення, розкладу, заміщення, обміну." Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку