Презентація «Класифікація хімічних реакцій» 9 клас
Про матеріал
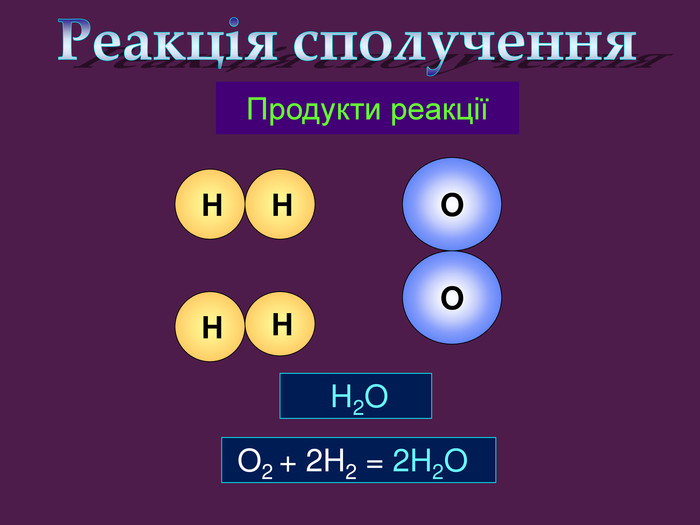
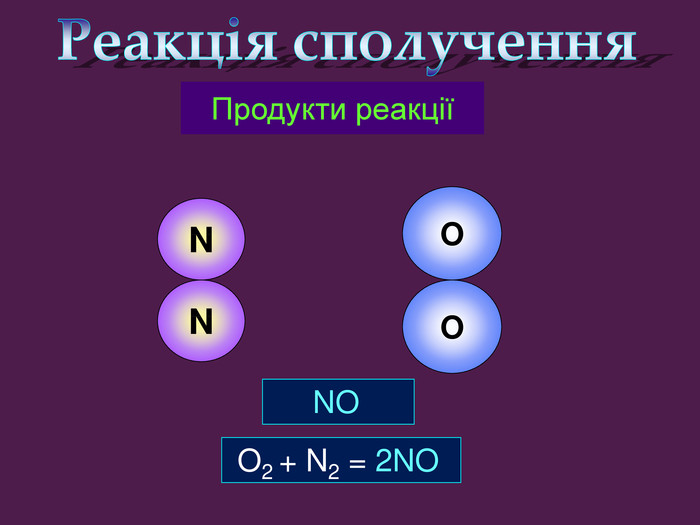
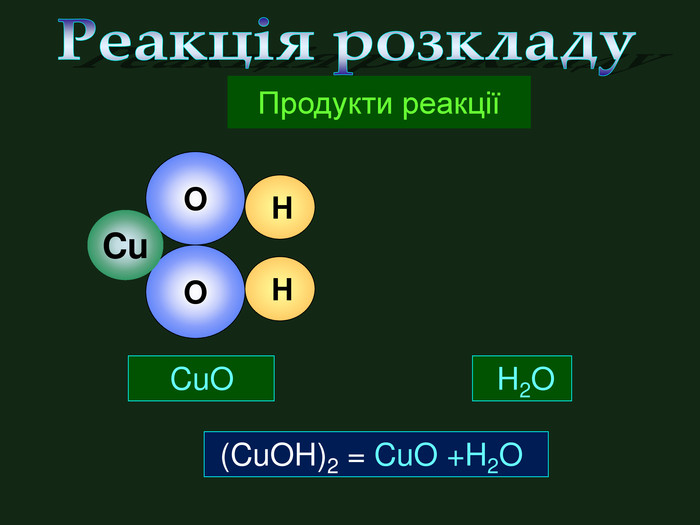
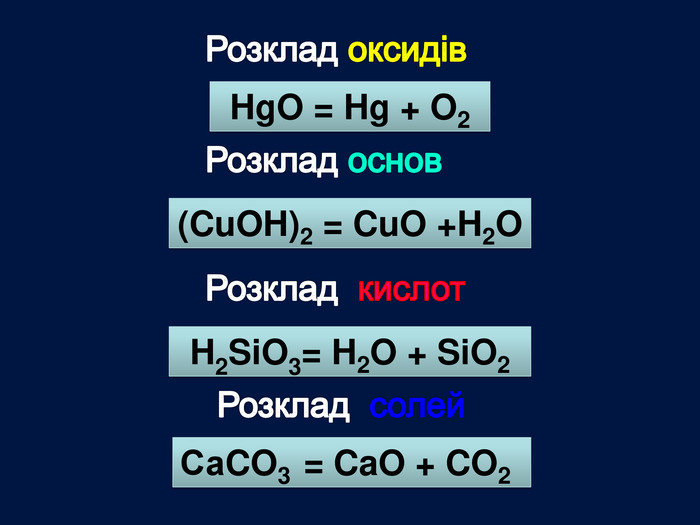
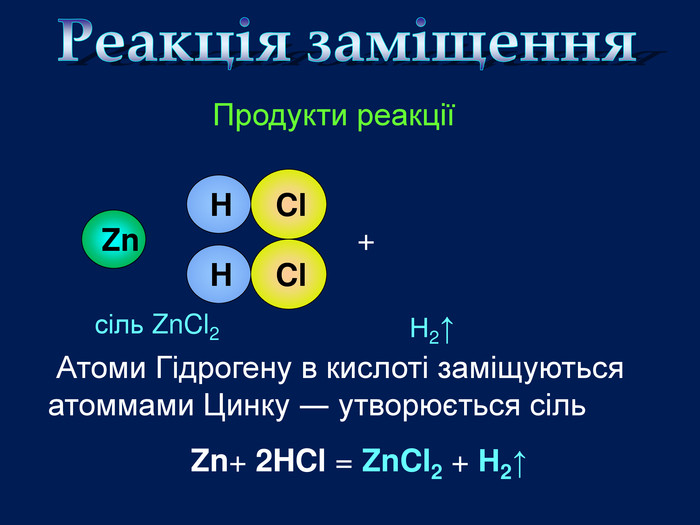
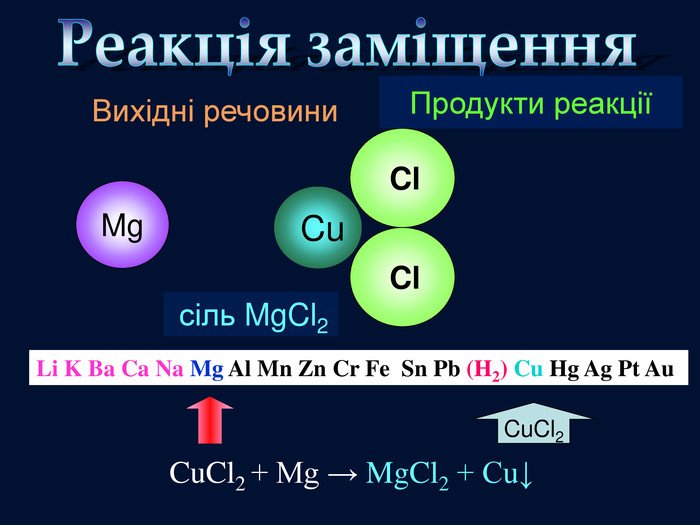
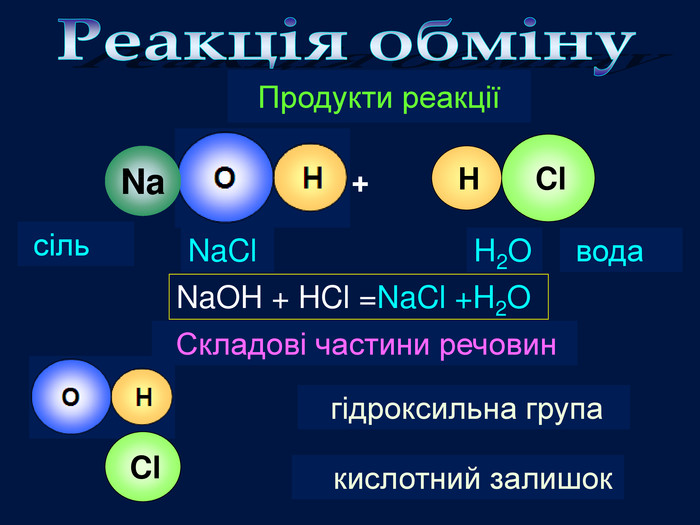
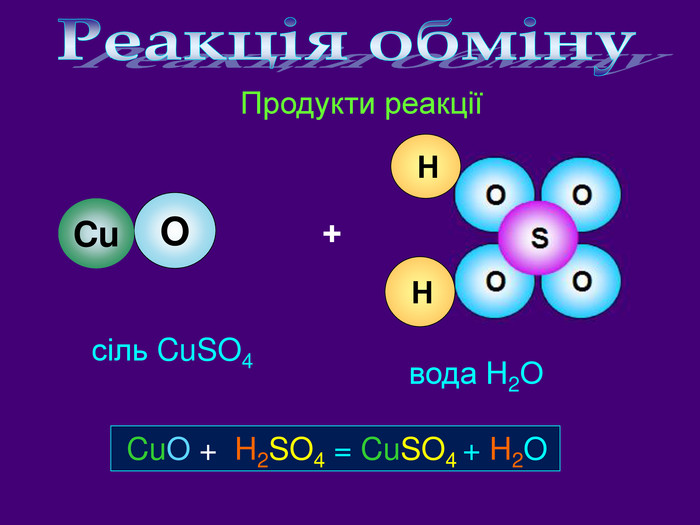
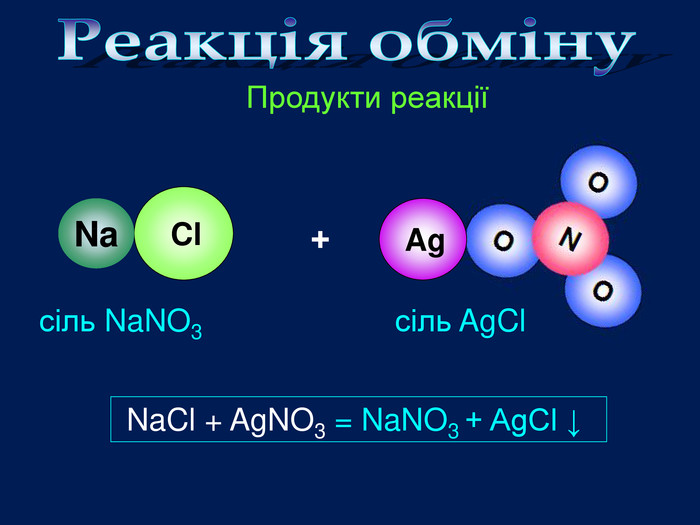
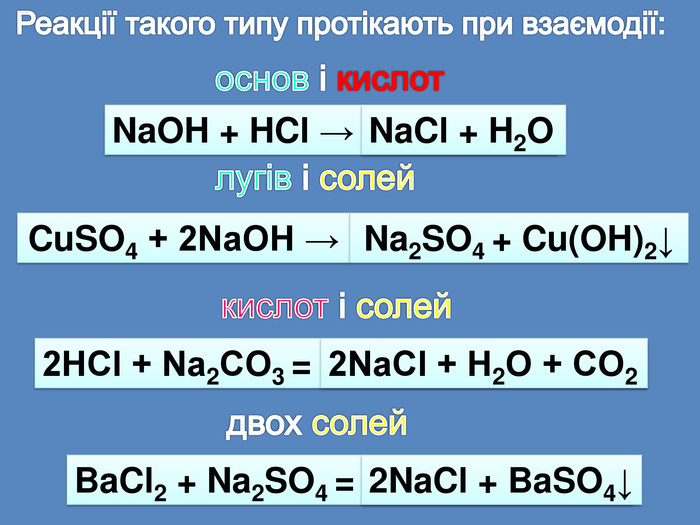
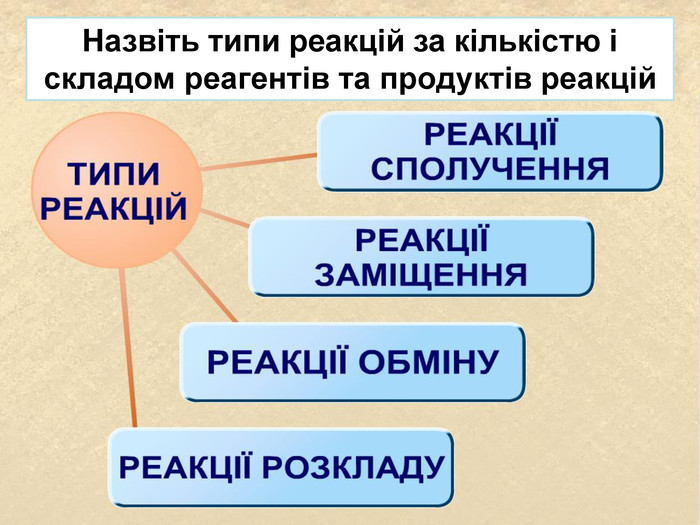
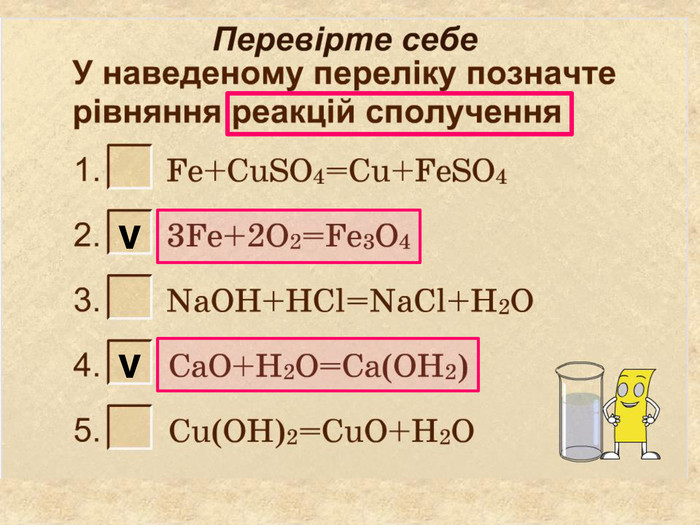
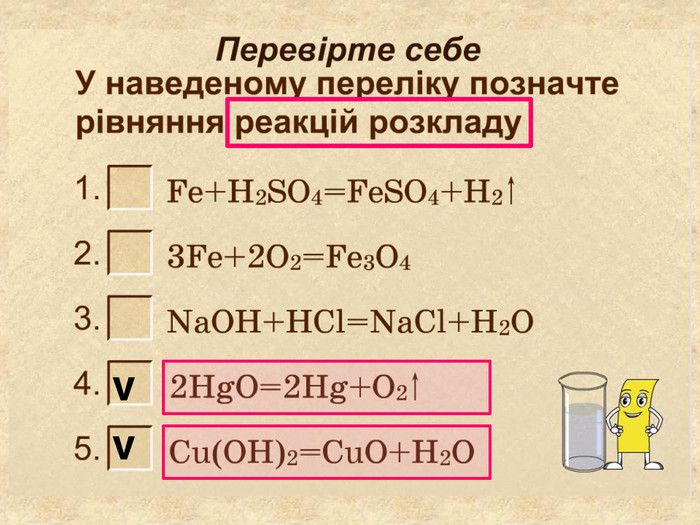
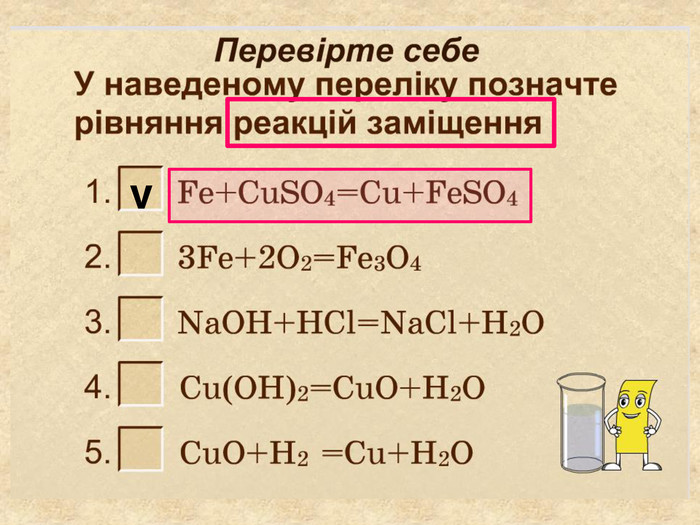
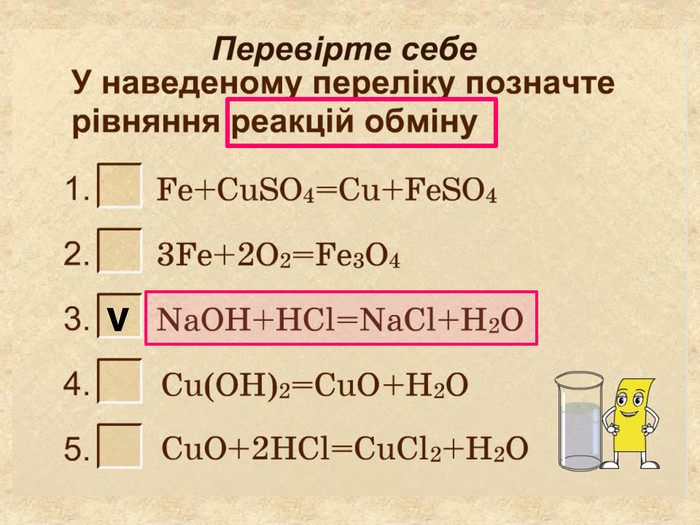
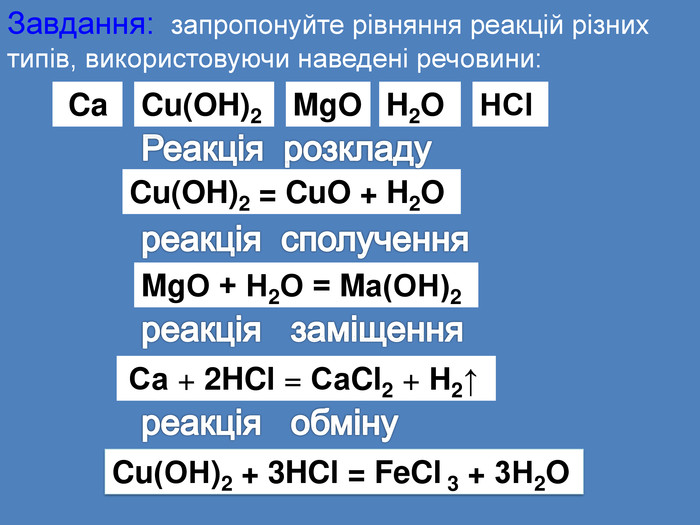
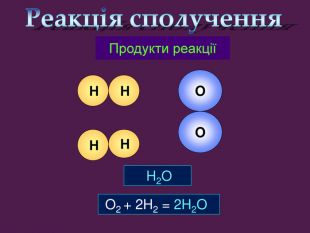
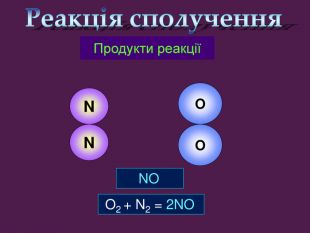
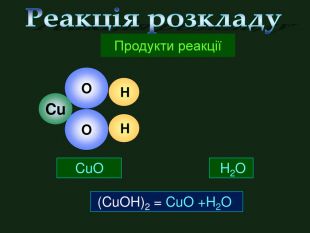
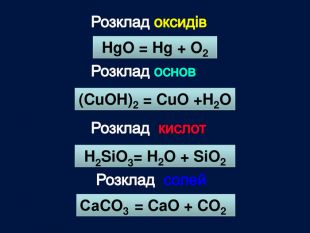
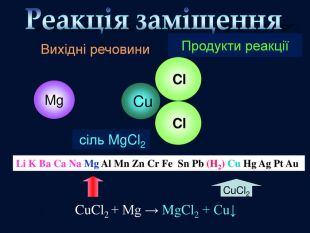
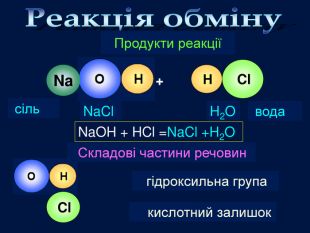
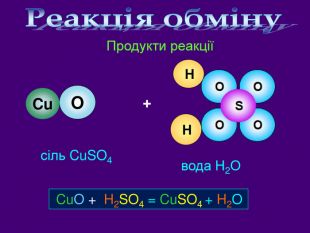
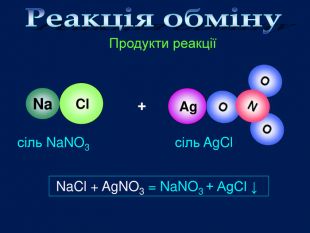
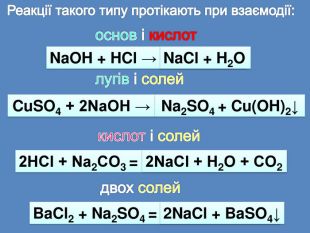
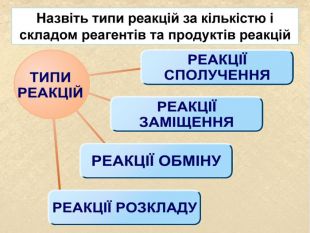
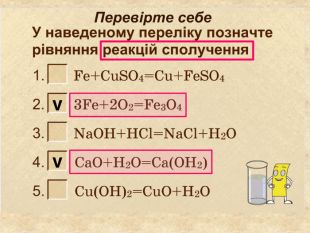
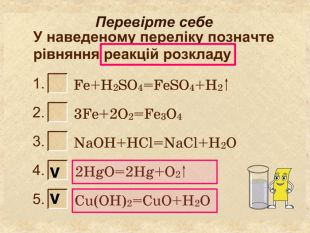
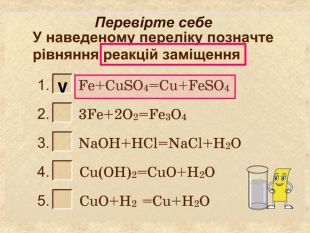
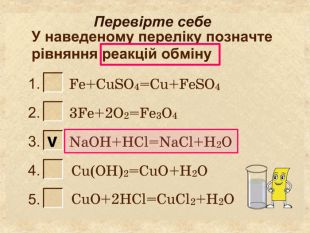
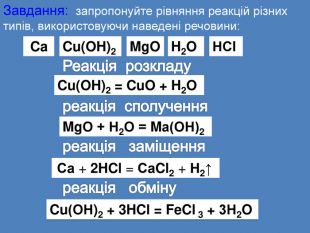
| Презентація допоможе провести урок на тему «Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакцій: реакції сполучення, розкладу, заміщення, обміну». Демонстрації анімаційних моделей реакції розкладу, сполучення, заміщення, обміну. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку






















-

Обертінська Вікторія
21.11.2021 в 17:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Токарчук Тетяна Василівна
21.11.2021 в 13:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бобрик Василь Вікторович
10.12.2020 в 19:17
Мені дуже подобається Ваша презентація)))
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гавдульська Ірина Ярославівна
06.12.2020 в 15:25
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гудзь Iра
30.11.2020 в 17:52
Часто користуюсь Вашими презентаціями. Мені подобаються!!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Максименко Ірина Василівна
04.12.2019 в 19:55
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Супрун Ольга Петрівна
13.11.2019 в 20:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Паращак Наталія Миколаївна
23.03.2018 в 12:03
Сподобались анімаційні моделі
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
Показати ще 5 відгуків