Презентація."Ковалентні карбон-карбонові зв’язки в молекулах органічних сполук, простий, подвійний, потрійний зв'язки, σ - зв’язки, π - зв’язки. Гібридизація атомних орбіталей".








* Атоми здатні взаємодіяти між собою з утворенням більш складних систем. Силу, яка діє між атомами і забезпечує сполучення їх у молекулу або кристал, називають хімічним зв’язком.* Обо’язковою умовою утворення хімічного зв’язку є зниження повної енергії системи (суми кінетичної і потенціальної енергій). Атоми, які приймають участь в утворенні зв’язку, прагнуть віддати, одержати або розділити з іншими атомами електрони, щоб придбати стійку восьми - або двоелектронну конфігурацію типу благородних газів ( октет). * Хімічний зв’язок характеризується типом зв’язку, енергією, що зумовлює його міцність, довжиною та напрямленістю, тобто кутами між зв’язками в молекулах, кристалах.* Найбільш поширеним типом хімічного зв’язку в молекулах органічних речовин є хімічний зв’язок, що здійснюється спільними електронами (ковалентний зв’язок). Для пояснення його суті розроблені дві теорії: теорія валентних зв’язків (ВЗ) та теорія молекулярних орбіталей (МО).
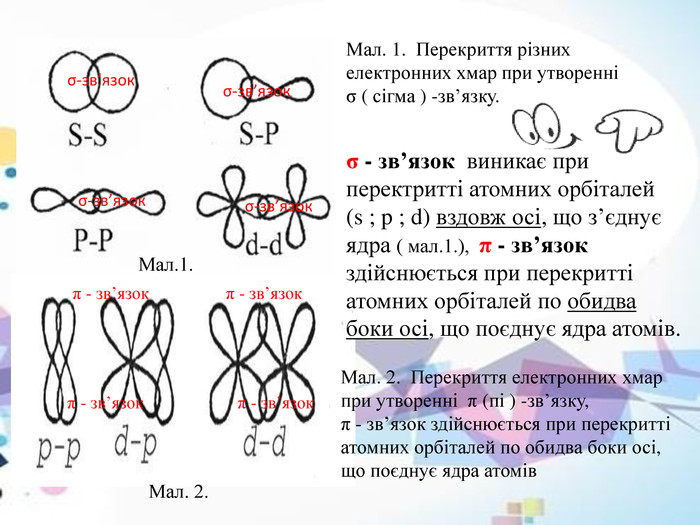
* Теорія валентних зв’язків (ВЗ) виходить з того, що ковалентний зв’язок утворюється двома неспареними електронами з антипаралельними спінами.* Більш загальною та універсальною є теорія молекулярних орбіталей(МО). Згідно з цією теорією електрони в молекулі знаходяться на молекулярних орбіталях, що охоплюють усі ядра атомів у молекулі.* В молекулах органічних сполук кожен атом карбону може утворювати чотири ковалентних зв’язки і брати участь у формуванні спільних електронних пар. Крім того, атом карбону має схильність (більше за всі інші хімічні елементи) утворювати гомоядерні зв’язки, створюючи так звані карбонові ланцюги (замкнуті, незамкнуті, розгалужені).* Механізм утворення ковалентного зв’язку шляхом усуспільнення неспарених електронів двох атомів дістав назву обмінного механізму. Можливий також інший механізм - донорно-акцепторний або координаційний. * Виникнення стійкої електронної структури атомів відбувається при утворенні одинарних та кратних зв’язків. У кратних зв’язках зв’язки нерівноцінні. Залежно від напрямлення перекриття атомних орбіталей розрізняють σ ( сігма)- та π( пі) -зв’язки.
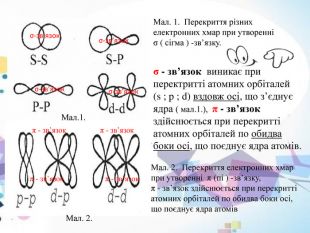
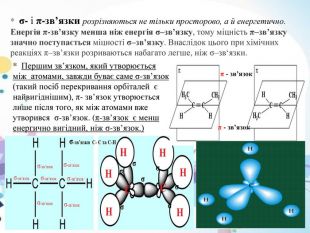
Мал. 1. Перекриття різних електронних хмар при утворенні σ ( сігма ) -зв’язку. Мал. 2. Перекриття електронних хмар при утворенні π (пі ) -зв’язку, π - зв’язок здійснюється при перекритті атомних орбіталей по обидва боки осі, що поєднує ядра атомів σ - зв’язок виникає при перектритті атомних орбіталей(s ; p ; d) вздовж осі, що з’єднує ядра ( мал.1.), π - зв’язок здійснюється при перекритті атомних орбіталей по обидва боки осі, що поєднує ядра атомів. σ-зв’язок σ-зв’язок σ-зв’язок σ-зв’язок π - зв’язок π - зв’язок Мал.1. Мал. 2. π - зв’язок π - зв’язок
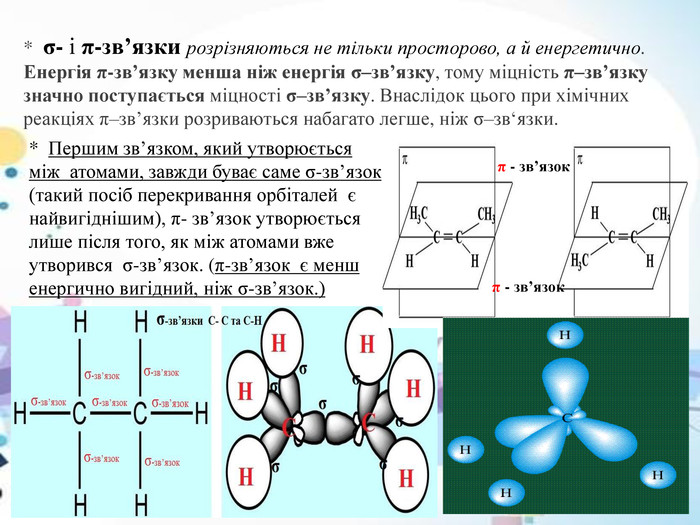
* σ- і π-зв’язки розрізняються не тільки просторово, а й енергетично. Енергія π-зв’язку менша ніж енергія σ–зв’язку, тому міцність π–зв’язку значно поступається міцності σ–зв’язку. Внаслідок цього при хімічних реакціях π–зв’язки розриваються набагато легше, ніж σ–зв‘язки. * Першим зв’язком, який утворюється між атомами, завжди буває саме σ-зв’язок (такий посіб перекривання орбіталей є найвигіднішим), π- зв’язок утворюється лише після того, як між атомами вже утворився σ-зв’язок. (π-зв’язок є менш енергично вигідний, ніж σ-зв’язок.) π - зв’язок π - зв’язок
* Існування великої кількості органічних сполук в значній міріобумовлено особливими властивостями атома Карбону. * В основному стані атом Карбону C(2s22p2) має два неспарених електрона на зовнішньому рівні електронної оболонки, такі електрони можуть утворювати тільки дві спільні електронні пари. * Стан атома Карбону, при якому він має чотири неспарених електрона і може мати можливість взяти участь в утворенні чотирьох спільних електронних пар, досягається переходом атома в збуджений стан (C*) при промотуванні (перенесенні) одного 2s-електрона на 2p-підрівень.* У збуджений стан атом карбону переходить під впливом певної кількості енергії, яку називають енергією збудження. Енергія збудження згодом перетворюється в енергію утворення зв’язків. https://uk.wikipedia.org/wiki/Вуглець
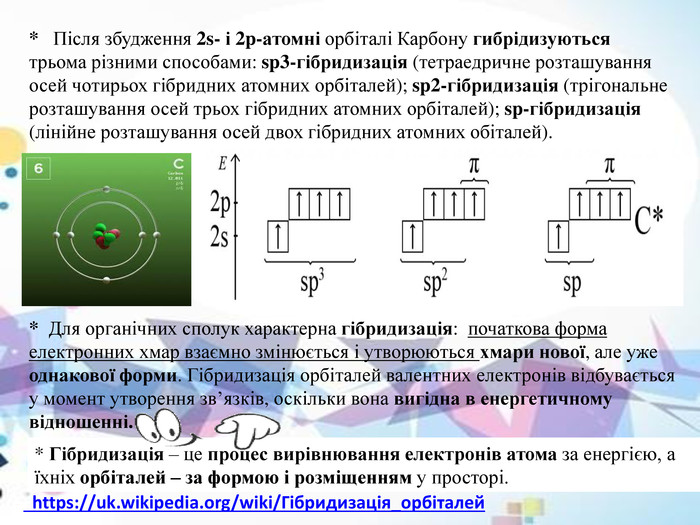
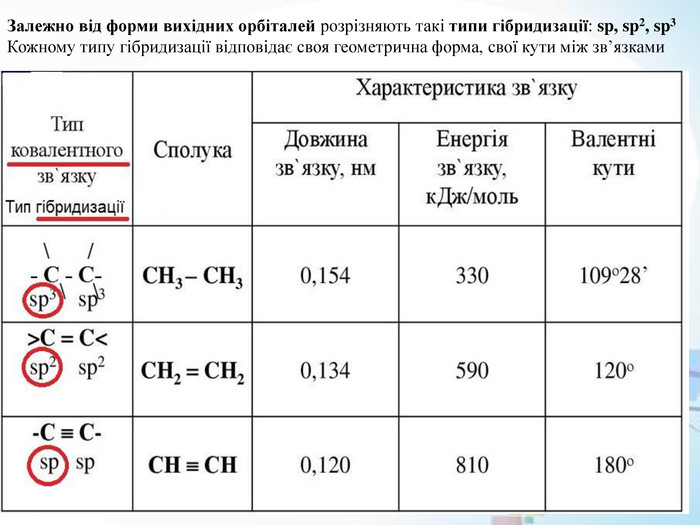
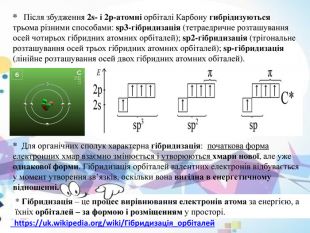
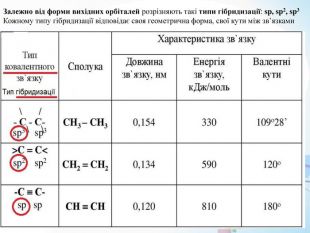
* Після збудження 2s- і 2p-атомні орбіталі Карбону гибрідизуються трьома різними способами: sp3-гібридизація (тетраедричне розташування осей чотирьох гібридних атомних орбіталей); sp2-гібридизація (трігональне розташування осей трьох гібридних атомних орбіталей); sp-гібридизація (лінійне розташування осей двох гібридних атомних обіталей).* Для органічних сполук характерна гібридизація: початкова форма електронних хмар взаємно змінюється і утворюються хмари нової, але уже однакової форми. Гібридизація орбіталей валентних електронів відбувається у момент утворення зв’язків, оскільки вона вигідна в енергетичному відношенні.* Гібридизація – це процес вирівнювання електронів атома за енергією, а їхніх орбіталей – за формою і розміщенням у просторі. https://uk.wikipedia.org/wiki/Гібридизація_орбіталей
* Однією з важливих особливостей органічних сполук, яка накладає відбиток на всю хімічну поведінку, є характер зв'язків між атомами в їхніх молекулах. У переважній більшості випадків ці зв'язки мають яскраво виражений ковалентний характер (шляхом усуспільнення неспарених електронів двох атомів )* Атом Карбону в молекулах таких сполук має чотири неспарені електрони на зовнішньому енергетичному рівні, відповідно він утворює в органічних сполуках чотири ковалентні зв'язки. При їхньому утворенні відбувається гібридизація атомних орбіталей, залежно від типу взаємодії між атомами Карбону. https://uk.wikipedia.org/wiki/Гібридизація_орбіталей* Для атома Карбону відомі стани гібридизації sp3, sp2 та sp, що умовно відповідають одинарному, подвійному, потрійному зв'язках між атомами Карбону. https://uk.wikipedia.org/wiki/Органічні_сполуки * Атоми Карбону можуть утворювати ланцюг з одинарним хімічним зв’язком між ними. Одинарний зв’язок карбон - карбон (-C -C-) зображується рискою «-». -C -C- ; -C- C-C- ; -C-C-C-C- ; -C-C-C-C-C-C- ; -C-C-C-C-C-C-C-C-
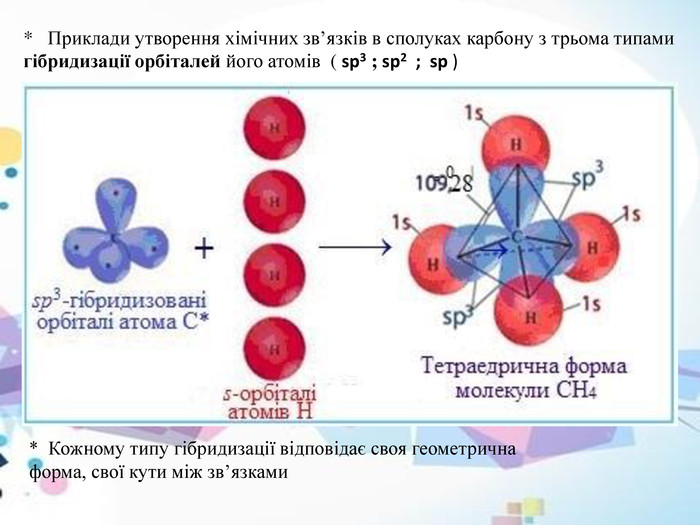
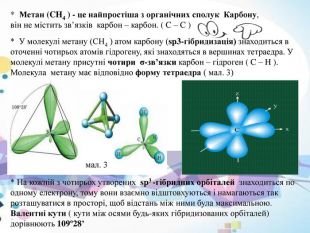
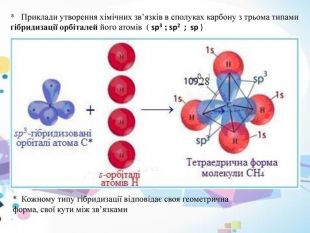
* Метан (CH4 ) - це найпростіша з органічних сполук Карбону, він не містить зв’язків карбон – карбон. ( C – C )* У молекулі метану (CH4 ) атом карбону (sp3-гібридизація) знаходиться в оточенні чотирьох атомів гідрогену, які знаходяться в вершинах тетраедра. У молекулі метану присутні чотири σ-зв’язки карбон – гідроген ( C – H ). Молекула метану має відповідно форму тетраедра ( мал. 3)мал. 3* На кожній з чотирьох утворених sp3 -гібридних орбіталей знаходиться по одному електрону, тому вони взаємно відштовхуються і намагаються так розташуватися в просторі, щоб відстань між ними була максимальною. Валентні кути ( кути між осями будь-яких гібридизованих орбіталей) дорівнюють 109º28’
* Етан (C2 H6 ) є другим (після метану) членом гомологічного ряду алканів – насичених ациклічних вуглеводнів ( парафінів). * У молекулі етану C2 H6 кожен атом карбону (sp3-гібридизація) знаходиться в оточенні трьох атомів гідрогену і одного атома карбону, які пов’язані σ-зв’язками. Три sp3-гібридних атомних орбіталі карбону перекриваються (створюють відповідні зв’язуючі молекулярні орбіталі з точки зору ММО) з трьома 1s-атомними орбіталями гідрогену, а четверта sp3-гібридна атомна орбіталь карбону утворює чисто ковалентний одинарний зв’язок C-C з іншим атомом карбону в тому ж стані.
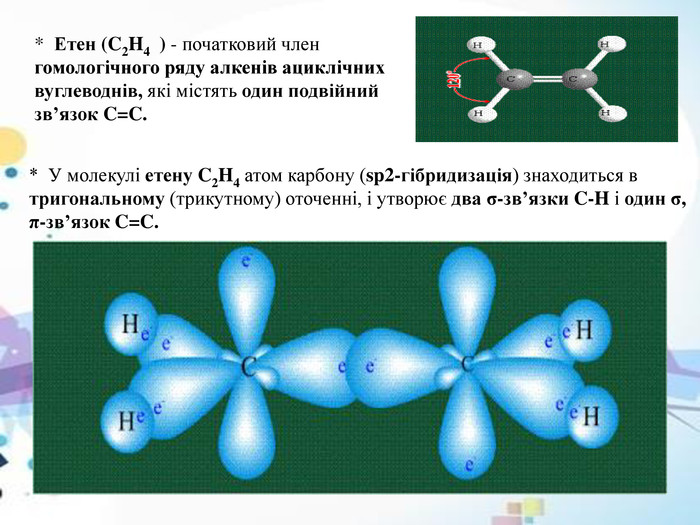
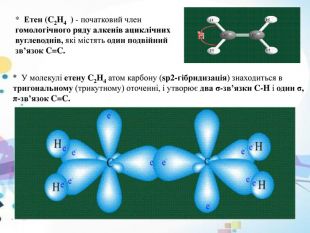
* Етен (C2 H4 ) - початковий член гомологічного ряду алкенів ациклічних вуглеводнів, які містять один подвійний зв’язок C=C.* У молекулі етену C2 H4 атом карбону (sp2-гібридизація) знаходиться в тригональному (трикутному) оточенні, і утворює два σ-зв’язки C-H і один σ, π-зв’язок C=C.
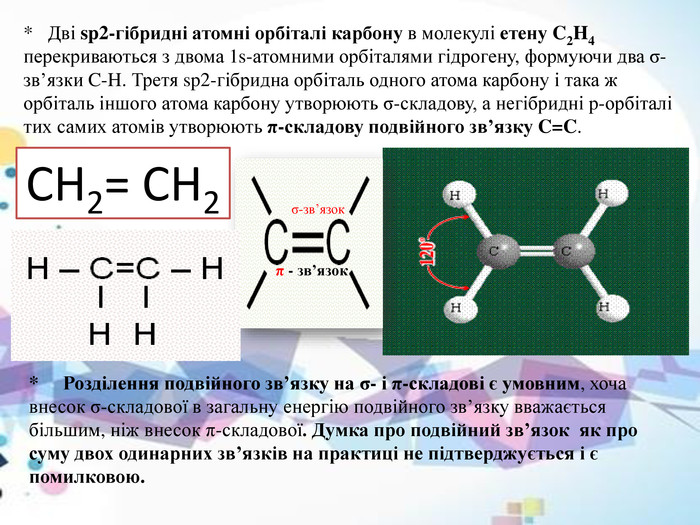
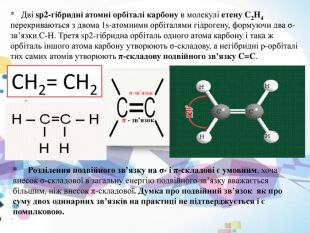
* Дві sp2-гібридні атомні орбіталі карбону в молекулі етену C2 H4 перекриваються з двома 1s-атомними орбіталями гідрогену, формуючи два σ-зв’язки C-H. Третя sp2-гібридна орбіталь одного атома карбону і така ж орбіталь іншого атома карбону утворюють σ-складову, а негібридні p-орбіталі тих самих атомів утворюють π-складову подвійного зв’язку C=C.* Розділення подвійного зв’язку на σ- і π-складові є умовним, хоча внесок σ-складової в загальну енергію подвійного зв’язку вважається більшим, ніж внесок π-складової. Думка про подвійний зв’язок як про суму двох одинарних зв’язків на практиці не підтверджується і є помилковою. СН2= СН2σ-зв’язок π - зв’язок
* У молекулі етіну (C2 H2 ) атом карбону (sp-гібридизація) знаходиться в лінійному (дигональному) оточенні і утворює один σ-зв’язок C-H і один σ,π,π-зв’язок C≡C. Одна sp-гібридна атомна орбіталь карбону перекривається з 1s-атомною орбіталью гідрогену і формується σ-зв’язок C-H. Друга sp-гібридна орбіталь одного атома карбону і така ж орбіталь другого атома карбону утворюють σ-складову, а негібридні p-орбіталі тих самих атомів – дві π-складові потрійного зв’язку C≡C.* Як і для подвійного зв’язку, розділення потрійного зв’язку на σ- і π-складові є умовним* При sp2- і sp-гібридизації тільки три або дві атомні орбіталі карбону беруть участь в утворенні σ-зв’язків. Решта атомних орбіталей (і електрони в них) мають можливість формувати π-складові кратних зв’язків вуглець – вуглець(C-C). Кратність хімічного зв’язку (з точки зору методу валентних зв’язків, МВЗ) – це число загальних електронних пар, що утворюють хімічний зв’язок між двома атомами ( подвійний або потрійний зв’язок ).


про публікацію авторської розробки
Додати розробку








-

Мандзюк Лідія
20.10.2023 в 18:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бурда Тетяна Валеріївна
01.10.2023 в 15:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Оксана Проценко Григорівна
17.09.2023 в 22:06
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Степанова Прасковія Федорівна
12.09.2023 в 20:53
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коваленко Зорина
25.09.2022 в 22:13
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука