Презентація "Лабораторні і промислові способи одержання кисню"


Презентація на тему “Добування кисню. Поняття про каталізатор.

Реакція розкладу”


 Методи добування кисню
Методи добування кисню
Лабораторні Промислові


Добування кисню в лабораторії
![]()
Розкладання калій перманганату KMnO₄

![]()
![]() 2KMnO₄ K₂MnO₄ + MnO₂ + O₂
2KMnO₄ K₂MnO₄ + MnO₂ + O₂
 Калій перманганат
Калій перманганат
Калій манганат
Манган (IV) оксид
Кисень
 Добування кисню в лабораторії
Добування кисню в лабораторії
![]()
Розкладання оксидів важких металів

![]()
![]() 2HgO 2Hg + O₂
2HgO 2Hg + O₂
 Меркурій(II) оксид
Меркурій(II) оксид
Кисень
1774р. -англійський хімік Джозеф Прістлі(1733-1804) одержав кисень розкладом меркурій(ІІ) оксиду
Добування кисню в лабораторії
![]()
Розкладання гідроген пероксиду H₂O₂

![]() H₂O₂ H₂ + 0₂
H₂O₂ H₂ + 0₂ ![]()
MnO₂ є каталізатором і прискорює хімічну реакцію
 гідроген пероксид
гідроген пероксид
водень кисень
Добування кисню в лабораторії
![]()
 Кисень виділяється під час нагрівання селітри 2 KNO₃ 2 KNO₂ + O₂
Кисень виділяється під час нагрівання селітри 2 KNO₃ 2 KNO₂ + O₂ 
Розклад індійської (або чилійської) селітри


 Способи збирання кисню в лабораторії
Способи збирання кисню в лабораторії
![]()

методом витіснення повітря методом витіснення води
 Промислові способи добування кисню
Промислові способи добування кисню
![]()
1. Розкладання води під дією електричного струму
 ел.струм
ел.струм
 2H₂O 2H₂
2H₂O 2H₂  + O₂
+ O₂
- Розділення повітря
З рідкого повітря (-200 градусів Цельсія) ректифікацією.
При -196 градусів Цельсія азот випаровується, а рідкий кисень залишається
 Каталізатор
Каталізатор
![]()
Речовина, яка змінює швидкість хімічних реакцій (найчастіше знижуючи її енергію активації), а сама після реакції залишається хімічно незмінною і в тій же кількості, що й до реакції.
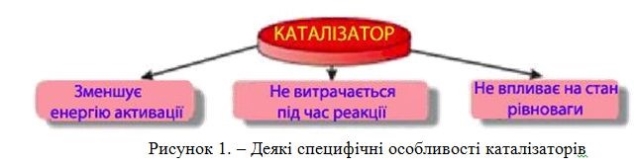

![]()



про публікацію авторської розробки
Додати розробку
