Презентація "Лужні та лужноземельні елементи"
Про матеріал
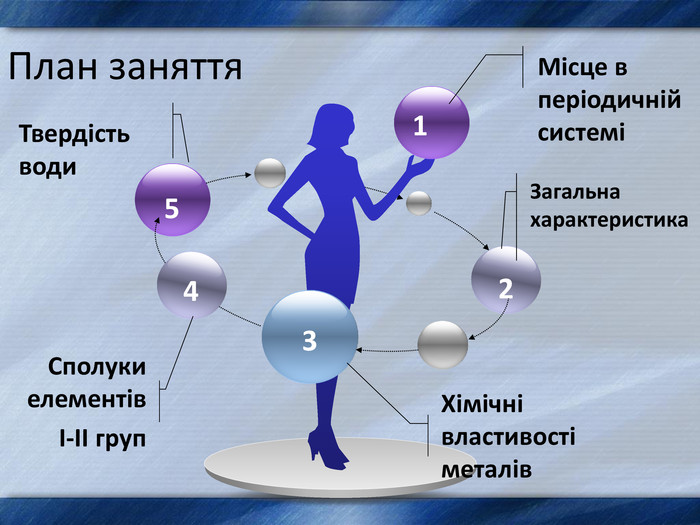
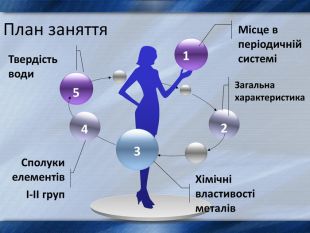
Матеріал в презентації розміщено за планом:
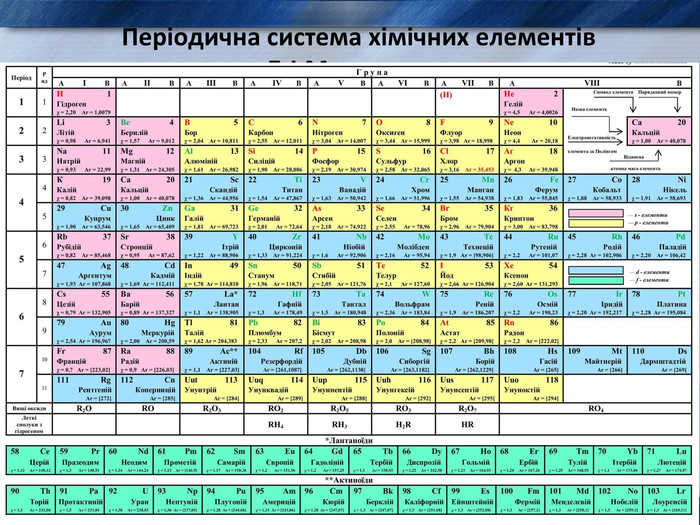
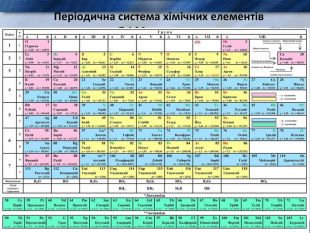
1. Місце металів в періодичній системі .
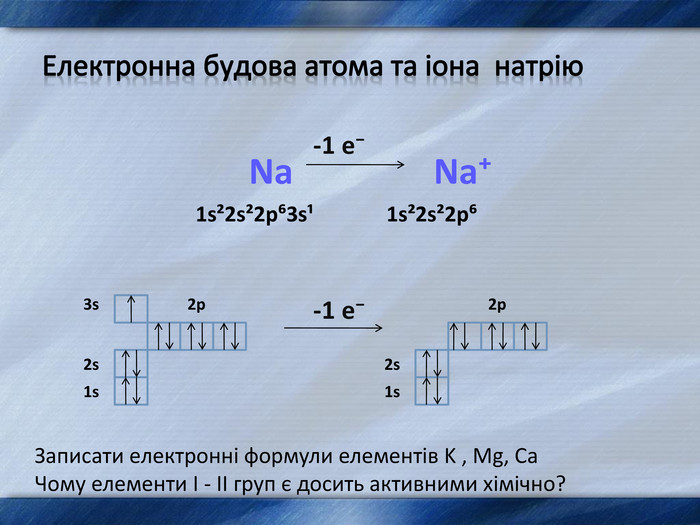
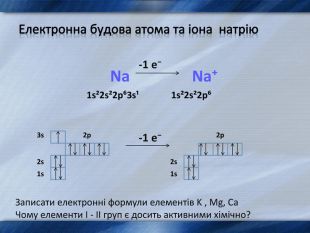
2. Будова атомів елементів І-ІІ груп головних підгруп.
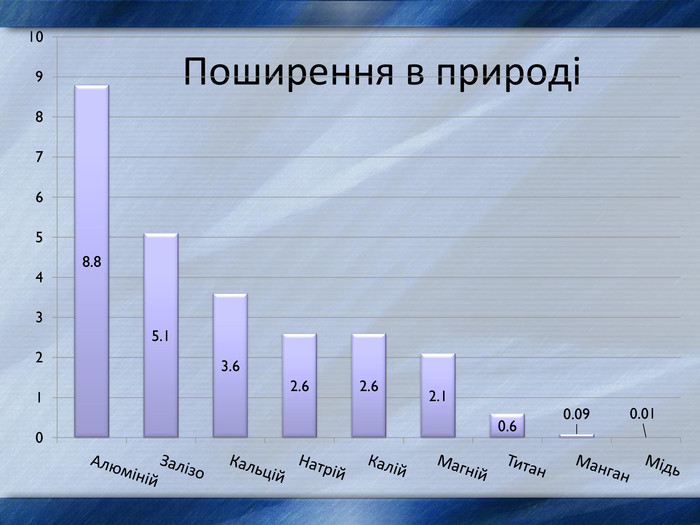
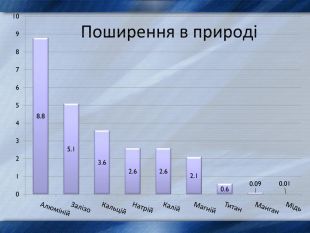
3. Фізичні властивості елементів .
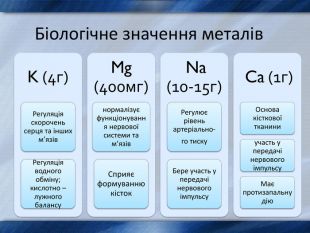
4. Хімічні властивості металів та їх сполук.
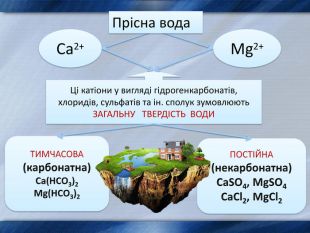
5. Твердість води та методи її усунення.
Перегляд файлу
Зміст слайдів
pptx
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку