Методична розробка "РОЗВ’ЯЗУВАННЯ ЗАДАЧ З ОРГАНІЧНОЇ ХІМІЇ (10 КЛАС)
Комунальний заклад «Гайворонський ліцей №2»
Гайворонської районної ради Кіровоградської області
РОЗВ’ЯЗУВАННЯ ЗАДАЧ
З ОРГАНІЧНОЇ ХІМІЇ
(10 КЛАС)
Швець Наталія Миколаївна,
вчитель хімії
ВСТУП
Навчальною програмою з хімії, яка розроблена на основі положень Державного стандарту базової та повної середньої освіти, передбачається вивчення найважливіших органічних сполук як в 9 класі, так і в 10.
З метою кращого засвоєння теоретичного матеріалу в програмі вивчення курсу «Органічна хімія» доцільно використовувати розрахункові задачі на виведення молекулярних формул органічних речовин.
Навчитися швидко і правильно розв’язувати задачі на виведення формул речовин можна використовуючи певні алгоритми та основні хімічні і фізичні властивості речовин.
Для формування основних умінь та навичок самостійного і раціонального розв’язування задач на встановлення формул основних класів органічних сполук пропонується систематизувати їх по вихідним даним:
- належністю до певного класу органiчних речовин;
- густиною та відносною густиною речовин;
- масовими частками елементiв;
- масами, об’ємами або кількістю речовини продуктів згоряння;
- якiсними хімічними властивостями речовин;
- об’ємними відношеннями газів;
- законом збереження маси речовини;
- рівнянням стану ідеальних газів;
- просторовою будовою молекул органічних речовин;
- співвідношенням мас.
Використання методичної розробки буде сприяти поглибленню рівня засвоєння теоретичного матеріалу, закріпленню вміння вирішувати проблемні завдання , організації самостійного навчання. Перш за все, ця розробка для молодих вчителiв. У ній розглянуто методику розв'язування розрахункових задач з хiмiї за програмою середньої школи. Дані рекомендацiї для розв'язування задач пiдвищеної складностi можуть бути використані пiд час пiдготовки вчителiв до ведення курсiв профiльного вивчення хiмiї, факультативiв, пiдготовки учнiв до олімпіад, ЗНО . Сподiваюсь, що дана методична розробка сприятиме вдосконаленню фахової майстерностi вчителiв хiмiї загальноосвiтніх шкіл.
РОЗВ’ЯЗУВАННЯ ЗАДАЧ НА ВСТАНОВЛЕННЯ ФОРМУЛ ОРГАНІЧНИХ СПОЛУК
І. Виведення молекулярної формули відповідного класу органічних сполук за густиною і молекулярною масою
Приклад
Відносна густина пари деякого алкану за повітрям дорівнює 3,931. Визначте формулу цього алкану і назвіть його.
![]() Дано: Розв’язування:
Дано: Розв’язування:
СnH2n+2 M(CnH2n+2)= (14n +2) г/моль
D(CnH2n+2)пов= 3,931 1. Обчислимо молярну масу алкану:
![]() СnH2n+2 - ? M(CnH2n+2) = D(CnH2n+2)пов
СnH2n+2 - ? M(CnH2n+2) = D(CnH2n+2)пов![]() Mпов;
Mпов;
Mпов=29г/моль
M(CnH2n+2) = 3,931 ![]() 29 г/моль = 114 г/моль
29 г/моль = 114 г/моль
2. Обчислимо число атомів Карбону в алкані:
12n + 2n+2 = 114; 14n = 112; ![]() ; С8Н18
; С8Н18
Відповідь: Формула сполуки С8Н18. Це октан.
Задачі для самоконтролю
- Визначте молекулярну формулу алкану, якщо відомо, що його пара в 2,5 раза важча, ніж аргон (С7Н16).
- Густина газуватого вуглеводню 1,965 г/мл за н.у. Розрахуйте молярну масу вуглеводню та назвіть його ( 44 г/моль, пропан).
- Встановіть молекулярну формулу вуглеводню, якщо густина його парів за повітрям дорівнює 4,07. (С9Н10)
ІІ. Виведення молекулярної формули за відомими масовими частками елементів
Приклад
Виведіть молекулярну формулу вуглеводню, масова частка Карбону в якому становить 82, 75%, а Гідрогену 17,25%. Відносна густина пари цього вуглеводню за повітрям дорівнює 2.
![]() Дано: Розв’язування:
Дано: Розв’язування:
ω(С) = 82,75% 1. Обчислюємо молярну масу вуглеводню:
ω(Н) = 17,25% ![]()
![]() D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів
D(CxHy)пов = 2 2. Виводимо алгоритм для встановлення кількості атомів
CxHy - ? Карбону та Гідрогену:
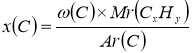
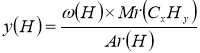
3. Обчислюємо число атомів Карбону і Гідрогену у вуглеводні (для розрахунків відсотки переводимо в частки):
![]()
![]()
Формула вуглеводню С4Н10
4. Робимо перевірку виведеної формули вуглеводню за молярною масою:
М(С4Н10)=58г/моль
Відповідь: формула вуглеводню С4Н10 (бутан)
Задачі для самоконтролю
- Речовини А і В належать до алкенів і мають однаковий склад за масовими частками елементів, а саме: 85,72% вуглецю (Карбону) та 14,28% водню (Гідрогену). Що це за речовини? Знайдіть молекулярні формули цих вуглеводнів, якщо відомо, що 1 л речовини А має масу 1,26 г, а речовини В – 2,52 г. Зазначте загальну кількість їхніх структурних ізомерів.
- Відносна густина за воднем речовини з масовими частками С – 54,55%, Н – 9,09%, О – 36,36% дорівнює 22. Вона легко відновлює оксид арґентуму і перетворює при цьому на органічну кислоту. Напишіть структурну формулу невідомої речовини (С2Н4О).
- Органічна речовина з масовою часткою Карбону 64,8%, Гідрогену – 13,5%, Оксигену – 21,6%, має відносну густину пари за повітрям 2,552. Виведіть молекулярну формулу речовини, напишіть формули її ізомерів і назвіть їх (С4Н9ОН).
ІІІ. Виведення молекулярної формули за відомими масою, об’ємами або кількістю речовини продуктів згоряння
Приклад
Внаслідок спалювання вуглеводню масою 1,5 г утворилися оксид карбону (ІV) об’єму 2,24 л (н.у.) та вода масою 2,7 г. Виведіть формулу вуглеводню, якщо відносна густина його за повітрям становить 1,0345.
![]() Дано: Розв’язування:
Дано: Розв’язування:
m(CxHy)=1,5г 1. Обчислимо молярну масу вуглеводню:
V(C xHy)=2,24 л ![]()
![]() m(H2O)=2,7г Mпов = 29 г/моль
m(H2O)=2,7г Mпов = 29 г/моль
![]() D(CxHy)пов=1,0345
D(CxHy)пов=1,0345 ![]()
CxHy - ? 2. Обчислимо кількість речовини вуглеводню масою 1,5 г:
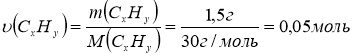
3. Обчислимо кількість речовини оксиду карбону (ІV) об’ємом 2,24 л:
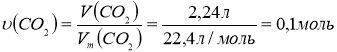
4. Обчислимо кількість речовини води масою 2,7 г:
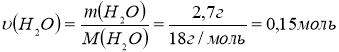
5. Обчислимо співвідношення кількостей речовин вуглеводню, оксиду карбону (ІV) та води:
υ (CxHy) : υ (СО2) : υ (Н2О) = 0,05 : 0,1 : 0,15
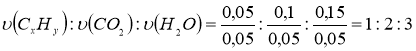
6. Обчислимо число атомів Карбону і Гідрогену у вуглеводні:
СхНу + О2 → 2 СО2 + 3Н2О
х=2; у=6; С2Н6; М(С2Н6) = 30 г/моль
Відповідь: Формула вуглеводню С2Н6 (етан)
Задачі для самоконтролю
- Внаслідок спалювання органічної речовини масою 4,8 г утворилися оксид карбону (IV) масою 6,6 г і вода масою 5,42 г. Відносна густина пари цієї речовини за воднем становить 16. Виведіть формулу речовини і напишіть її структурну формулу. (СН3ОН).
- У результаті спалювання 7,2 г органічної сполуки, густина парів якої за воднем дорівнює 36, утворилось 22 г оксиду карбону(IV) і 10,8 г води. Визначне формулу вихідної сполуки.
IV. Виведення молекулярної формули за витраченим об’ємом кисню для спалювання органічної речовини
Приклад
На спалення 0,5 моль етиленового вуглеводню витрачається 33,6 л кисню (н.у.). Встановити формулу сполуки.
![]() Дано: Розв’язування:
Дано: Розв’язування:
υ(СnH2n) = 0,5 моль 1. Знаходимо кількість кисню:
![]() V(O2) = 33,6 л
V(O2) = 33,6 л 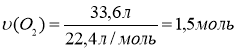
СnH2n - ? 2. Складаємо рівняння реакції горіння етиленового вуглеводню у загальному вигляді і розставляємо коефіцієнти:
СnH2n + хO2 → nСО2 + nН2О
n+2n=2x
3n=2x
![]()
3.Складаємо пропорцію:
На 1 моль СnH2n йде 1,5 моль O2 (n)
На 0,5 моль СnH2n йде 1,5 моль О2 (за умовою)
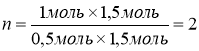
Отже, у молекулі етиленового вуглеводню два атоми Карбону. А на два атоми Карбону припадає чотири атоми Гідрогену. Формула вуглеводню С2Н4, це етилен.
Відповідь: формула вуглеводню С2Н4 (етилен)
Задачі для самоконтролю
- Визначте молекулярну формулу алкану, якщо відомо, що для його спалювання витратили 10 л кисню, в результаті чого утворилось 6 л вуглекислого газу. Який об’єм алкану прореагував? (С3Н8 2 л)
- Визначте формулу алкіну, для повного згорання 20 л якого потрібно 110 л кисню. Об’єми газів виміряні за однакових умов. (С4Н6)
V. Виведення молекулярної формули за масами продуктів приєднання
Приклад №1
При дегідратації первинного насиченого спирту утворився газоподібний алкен, об’єм якого виявився в 4 рази меншим, ніж об’єм карбон(VI)оксиду, що утворився при спалювані такої ж кількості спирту. Одержаний алкен може повністю знебарвити розчин бромної води, де міститься 16г брому. Який спирт піддали дегідратації?
Дано: Розв’язування:
![]() Складаємо рівняння відповідних реакцій:
Складаємо рівняння відповідних реакцій:
![]() m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
m(Br2) = 16г 1) Дегідратація первинного насиченого спирту:
![]() СnH2n+1OH - ? СnH2n+1OH → СnH2n + H2O
СnH2n+1OH - ? СnH2n+1OH → СnH2n + H2O
2) Горіння первинного насиченого спирту:
СnH2n+1OH + О2 → СО2 + Н2О
3) Приєднання брому алкеном:
СnH2n + Br2 → СnH2n Br2
Складаємо співвідношення реагуючих речовин та продуктів реакції:
V(СnH2n) : V (CO2) = 1:4
4) Знаходимо кількість речовини брому:
![]() , за рівнянням υ(СnH2n) = 0,1 моль
, за рівнянням υ(СnH2n) = 0,1 моль
5) За умовою задачі:
1V СnH2n → 4V CO2
υ(СnH2n) = 0,1 моль
υ(CO2) = 0,4 моль
υ(СnH2n): υ(CO2) = 0,1 : 0,4 = 1:4
6) Формула алкену містить 4 атоми Карбону: С4Н8
При гідратації алкену добудемо одноатомний насичений спирт С4Н9ОН
Відповідь: С4Н9ОН – бутанол
Приклад №2
Для каталітичного гідрування алкіну невідомого складу потрібно використати 1,7 л водню (н.у.). Така ж сама маса вуглеводню під час взаємодії з бромом утворює 15,24 г тетраброміду з розгалуженим карбоновим скелетом. Визначте формулу алкіну.
![]() Дано: Розв’язування:
Дано: Розв’язування:
V(H2) = 1,7 л 1. Складаємо рівняння відповідних реакцій:
m(СnH2n-2Br4) = 15,24г СnH2n-2 + 2H2 ![]() СnH2n+2
СnH2n+2
![]() СnH2n-2 + 2Br2
СnH2n-2 + 2Br2 ![]() СnH2n-2Br4
СnH2n-2Br4
СnH2n - ? 2. Обчислимо кількість речовини водню що вступив у реакцію каталітичного гідрування алкіну :
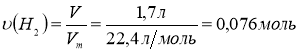
3. Обчислимо кількість речовини брому, що вступив у реакцію:
υ(Br2)= 0,076 моль
4. Обчислимо масу брому:
m(Br2) = М ∙ υ = 160 г/моль ∙ 0,076 моль = 12,16 г
5. Обчислимо масу алкіну:
m(СnH2n-2) = m(СnH2n-2Br4) – m(Br2) = 15,24 – 12,16 = 3,08 г
6. Обчислюємо кількість речовини алкіну за рівнянням реакції приєднання брому:
υ(СnH2n-2) = υ(Br2)/2 = 0,076/2 = 0,038 моль
7. Обчислюємо молярну масу алкіну:
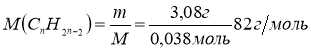
8. Обчислюємо число атомів Карбону в алкіні:
12n + 2n – 2 = 82
14n = 84
n=6
9. Виводимо формулу алкіну:
С6H10
Відповідь: формула алкіну С6H10 (гексин)
Задачі для самоконтролю
- Ацетиленовий вуглеводень маса якого 10,8 г повністю прореагував з 14,6 г хлороводню. Визначте формулу сполуки (С4Н6).
- Під час реакції етиленового вуглеводню з хлором у темряві утворюється 42,3 г дихлориду, а під час реакції зразку такої ж маси з бромом в тетрахлоретані – 69 г диброміду. З’ясуйте формулу вихідного вуглеводню (С5Н10).
- Алкін масою 12,3 г в реакції з надлишком брому утворює продукт приєднання масою 60,3 г. Визначте формулу алкіну. (С6Н10)
VІ. Виведення молекулярної формули за рівнянням стану ідеальних газів
Приклад
У сталеву посудину, місткість якої 2,75л, помістили 1,32г насиченого одноатомного спирту. Потім туди ввели 3,36л кисню (н. у.). Після підпалювання спирт повністю згорів, при цьому тиск у посудині за температурою 227ºС становив 306 кПа. Визначте формулу спирту.
![]() Дано: Розв'язування:
Дано: Розв'язування:
Vпосуду = 2,75л 1) За рівнянням Менделєєва-Клапейрона:
m(CnH2n+1OH) = 1,32г ![]()
V(O2) = 3,36л Виводимо формулу для визначення кількості речовини суміші
T = 227ºС продуктів згорання:
![]() P =306 кПа
P =306 кПа ![]() , Т = 227 + 273 = 500 К;
, Т = 227 + 273 = 500 К;
CnH2n+1OH - ? ![]()
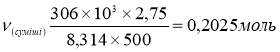
2) За Законом збереження мас речовин Ломоносова, знаходимо масу кисню витраченого для спалювання насиченого одноатомного спирту:
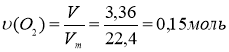
![]()
3) Маса вихідних речовин:
![]()
Маса продуктів реакції:
![]()
![]()
Приймаємо υ(СО2) = х,
υ(Н2О) = 0,2025-х
Складаємо математичне рівняння за законом збереження мас речовин:
6,12 = 44х + (0,2025-х)18
6,12 = 44х + 3,645 – 18х
2,475 = 26х
х = 0,095
Отже, υ(СО2) =0,095 моль, υ(Н2О) = 0,1075 моль
4) Складаємо рівняння реакції горіння насиченого одноатомного спирту:
CnH2n+1OH + О2 → 5СО2 + 6Н2О
За співвідношенням υ(СО2) : υ(Н2О) = 0,095:0,1075 = 5:6
В сполуці спирту 5 атомів Карбону і 12 атомів Гідрогену.
Отже формула насиченого одноатомного спирту С5Н11ОН
Відповідь: С5Н11ОН – пентанол (аміловий спирт)
Задачі для самоконтролю
- Вуглеводень масою 10,2 г займає об’єм 6,20 л за тиску 0,92 атм і температури 27˚С. Назвіть цей вуглеводень. (пропан)
- Невідомий насичений альдегід кількості речовин 0,01 моль спалили в закритій посудині, об’ємом якої 3 л, в атмосфері кисню, який за нормальних умов займає об’єм 5,6 л. Після повного спалювання альдегіду температура в посудині становила 200°С, тиск піднявся до 360,31 кПа. Визначте формулу альдегіду.(С4Н8О)
- Зразок речовини, маса якої 2,88 г, у реакції з надлишком натрію утворив 289 мл водню за температури 298К і тиску 101,3 кПа. Під час спалювання 54 мг вихідної речовини одержали 99 мг карбон (VI) оксиду і 27 мл вод. Повністю випарувавшись 1,8 г речовини, одержали її пари, об’єм яких за температури 473 і тиску 101,3 кПа становив 0,97 л. Визначіть формулу вихідної сполуки. (С2Н3СООН – акрилова кислота).
VІІ. Виведення молекулярної формули за хімічними властивостями речовин
Приклад №1
Етиленовий вуглеводень, що утворився із 24 г одноатомного насиченого спирту при нагріванні з концентрованою сульфатною кислотою, приєднує 15,3 мл брому (ρ = 3,14 г/см3). Який спирт використали для реакції? Врахуйте, що масова частка виходу алкену становить 75% від теоретичного.
![]() Дано: Розв’язування:
Дано: Розв’язування:
m(СnH2n+1OH) = 24г 1. Визначаємо масу брому, що приєднує алкен:
V(Br2) = 15,3мл m(Br2) = ρ ∙V = 15,3 мл ∙3,14 г/мл = 48 г
ρ = 3,14 г/см3 2. Визначаємо кількість речовини брому:
![]() ωвих. (СnH2n) = 75%
ωвих. (СnH2n) = 75% 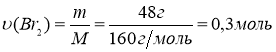
СnH2n+1OH - ?
3. Складаємо рівняння відповідних реакцій:
СnH2n + Br2 ![]() СnH2nBr2
СnH2nBr2
СnH2n+1OH ![]() СnH2n + H2O
СnH2n + H2O
4. Визначаємо практичну кількість речовини алкену, що приєднує бром:
υ(Br2) = υпр.(СnH2n) = 0,3 моль
5. Обчислимо теоретичну кількість виходу алкену:
![]()
6. Обчислимо молярну масу одноатомного насиченого спирту:
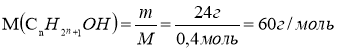
7. Обчислимо число атомів Карбону в сполуці спирту :
12n +2n +1 +17 = 60
14n =42
n=3
8. Виводимо формулу одноатомного насиченого спирту: С3Н7OH
Відповідь: для реакції використали пропанол (С3Н7OH)
Приклад №2
Внаслідок нагрівання насиченого одноатомного спирту з концентрованою йодидною кислотою утворилась сполука, в якій масова частка йоду становить 74,7%. Визначте формулу одноатомного спирту.
![]() Дано: Розв’язування:
Дано: Розв’язування:
СnH2n+1OH СnH2n+1OH + НI → СnH2n+1I + H2O
![]() ω(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
ω(I) = 74,7% Mr(СnH2n+1I) = 14n + 128
СnH2n+1OH - ? 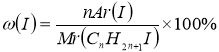
![]()
74,7 (14n + 128) = 12700
1045,8n + 9561,6 = 12700
1045,8n = 3138,4
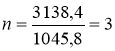 ; С3Н7ОН
; С3Н7ОН
Відповідь: Формула спирту С3Н7ОН (пропанол)
Приклад №3
Маса продукту приєднання гідроген броміду до вуглеводню етиленового ряду
виявилась у 2,929 раза більшою за масу вихідного вуглеводню. Визначте формулу етиленового вуглеводню.
![]() Дано: Розв’язування:
Дано: Розв’язування:
m(CnH2n) ×2,929 = 1. Складаємо рівняння реакції:
![]() m(CnH2n+1Br) CnH2n + НBr → CnH2n+1Br
m(CnH2n+1Br) CnH2n + НBr → CnH2n+1Br
CnH2n - ? 2. Приймаємо m(CnH2n) за х, згідно умови m(CnH2n+1Br)=2,929 х
3. Складаємо співвідношення за кількістю речовин реагентів і продуктів реакції:
υ(CnH2n)= υ(CnH2n+1Br)
4. Визначаємо молярні маси реагентів і продуктів реакції:
М(CnH2n)=12n +2n = 14n
M(CnH2n+1Br)=14n+81
5. Визначаємо кількості речовин:
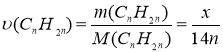
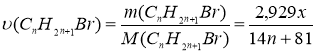
6. Встановлюємо кількість атомів Карбону у сполуках за пропорцією:
![]()
n=3
Отже, у молекулі етиленового вуглеводню 3 атоми Карбону та 6 атомів Гідрогену. Формула вуглеводню C3H6 – пропен.
Відповідь: Формула етиленового вуглеводню C3H6 ( пропен).
Приклад №4
В результаті дії натрію на 13,8г суміші етилового спирту і одноосновної органічної кислоти виділяється 3,36л газу, а в результаті дії на таку ж саму суміш насиченого розчину гідроген карбонату натрію – 1,12л газу. Визначте будову органічної кислоти .
![]() Дано: Розв’язування:
Дано: Розв’язування:
mсум.(СnH2n+1COOH; 1. Складаємо рівняння реакції взаємодії
C2H5OH) = 13,8 г органічної кислоти та натрій гідроген
V1 заг.(газу) = 3,36 л карбонату:
V2 (газу) =1,12 л СnH2n+1COOH + NaHCO3 → СnH2n+1COONa+ H2O + CO2
![]() Na, NaHCO3 Висновок виділяється вуглекислий газ об’ємом 1,12 л
Na, NaHCO3 Висновок виділяється вуглекислий газ об’ємом 1,12 л
СnH2n+1COOH - ? 2. Визначаємо кількості речовин вуглекислого газу і
ω(СnH2n+1COOH) - ? органічної кислоти за рівнянням реакції:
ω(C2H5OH) - ? υ(CO2) = υ.(СnH2n+1COOH)
υ(СnH2n+1COOH) = 0,05 моль
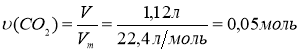
3. При взаємодії натрію як з органічною кислотою так і спиртом виділяється водень:
V1 заг.(Н2) = 3,36л;
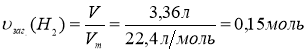
4. Складаємо рівняння реакції взаємодії органічної кислоти з натрієм:
2СnH2n+1COOH + 2Na → 2СnH2n+1COONa + H2↑
З попередніх розрахунків υ(СnH2n+1COOH) складає 0,05 моль, отже υ1(Н2) за рівнянням реакції дорівнює 0,025 моль:

про публікацію авторської розробки
Додати розробку

-

Слєпєндяєва Олена Вікторівна
16.06.2024 в 19:48
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Олена Мироненко
20.02.2024 в 21:15
Щиро дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Яценко Іванна Сергіївна
28.11.2023 в 06:57
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Лаухіна Ганна Олександрівна
26.09.2023 в 18:31
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Перевозникова Наталія
04.11.2022 в 12:47
Дякую за вашу працю, за те, що ділитися своїми розробками. Дякую.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Примаченко Ірина
31.10.2022 в 20:50
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Велика Наталія Миколаївна
14.09.2022 в 20:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Рутта Світлана Григорівна
10.05.2022 в 22:13
Дуже дякую за корисну розробку!!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Руда Софія
03.12.2021 в 15:27
чудовий матеріал
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Соломко Юлия
22.11.2021 в 19:24
дякую
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Samar Angelina
21.11.2021 в 22:04
Чудовий матеріал.
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Тимошенко Аліна Йосипівна
09.11.2021 в 15:56
Дякую!
Загальна:
4.7
Структурованість
5.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Вініченко Людмила Василівна
02.11.2021 в 17:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бицина Оксана Валеріївна
04.10.2021 в 12:36
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Радєва Ірина Ігорівна
13.05.2021 в 22:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Калинич Людмила Андріївна
11.11.2020 в 20:59
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мельникова Ольга Анатоліївна
10.11.2020 в 22:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сміян Михайло Сергійович
24.08.2020 в 19:04
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грабітченко Тетяна
06.07.2020 в 18:59
Дякую за чудову роботу!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Бондаренко Алла Миколаївна
20.01.2020 в 20:51
Дякую автору за чудову розробку.
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Козачок Ольга Олександрівна
26.11.2019 в 20:29
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Іванченко Ніна Павлівна
26.11.2019 в 17:31
можна тільки подякувати автору
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сільвейструк Надія Анатоліївна
22.10.2019 в 22:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Жукова Наталія
23.04.2019 в 13:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 21 відгук