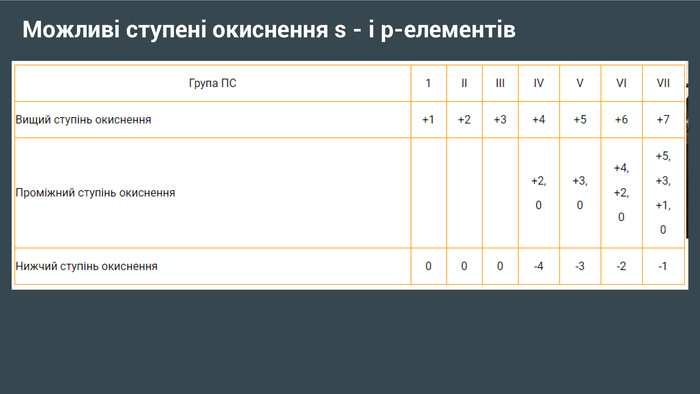
Презентація "Можливі ступені окиснення неметалів ІІ-ІІІ періодів"
Про матеріал
Презентація " Можливі ступені окиснення неметалів ІІ-ІІІ періодів ". Презентація для учнів 11 класу з хімії. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку