Презентація на тему " Алкени" для 10 класу за новою програмою
Про матеріал
Презентація на тему " Алкени" для 10 класу за новою програмою. Сьогодні презентація стала актуальним інструментом на кожному уроці в творчого вчителя, так як допомагає провести урок цікаво та доступно. Стане в пригоді кожному творчому вчителю.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



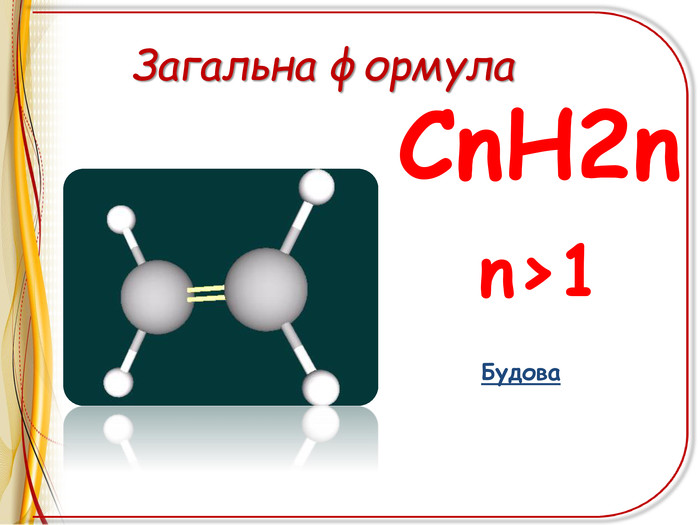
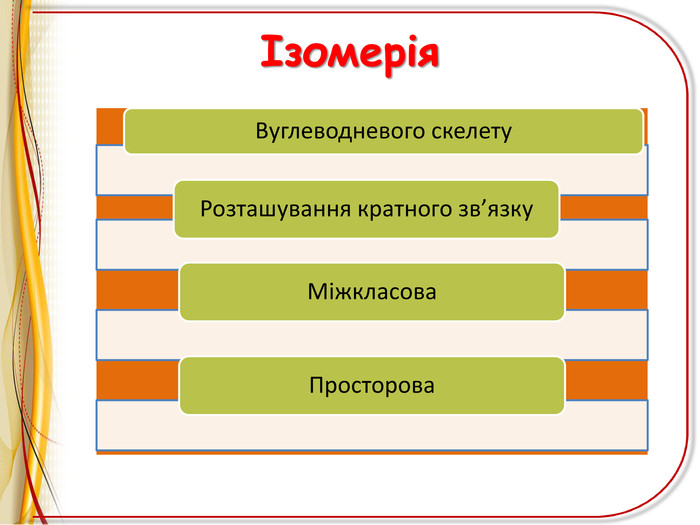
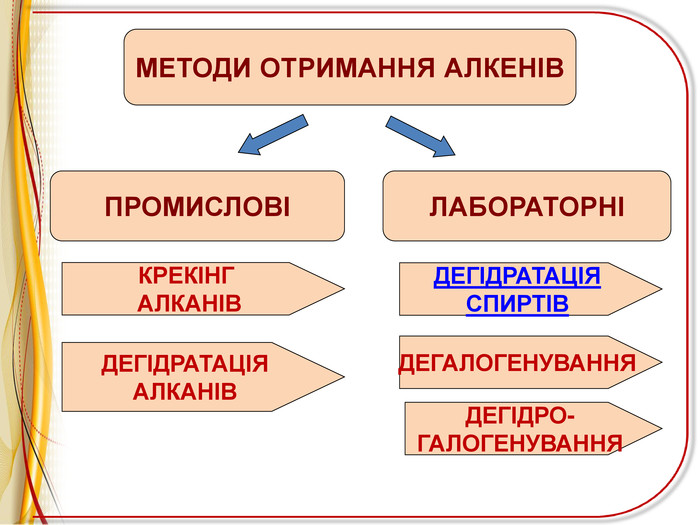
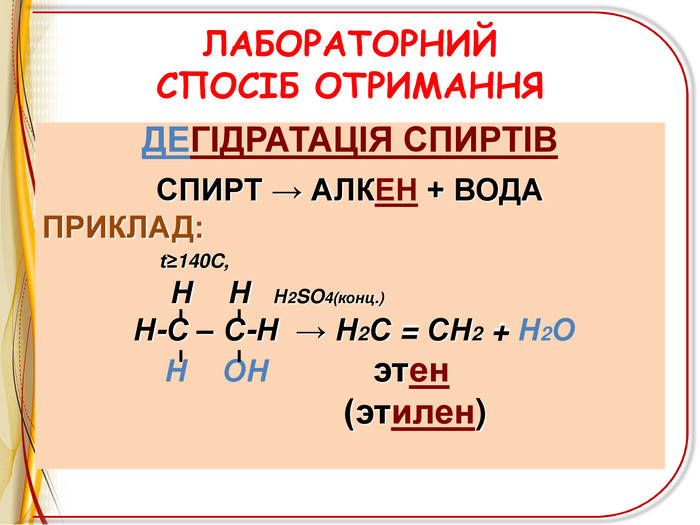

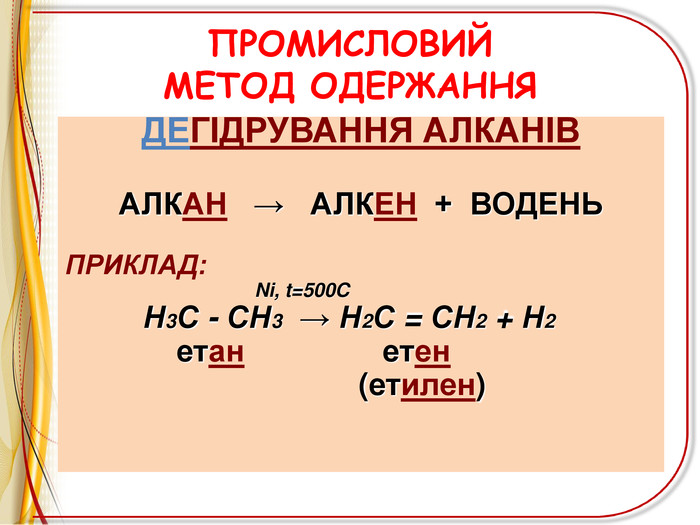
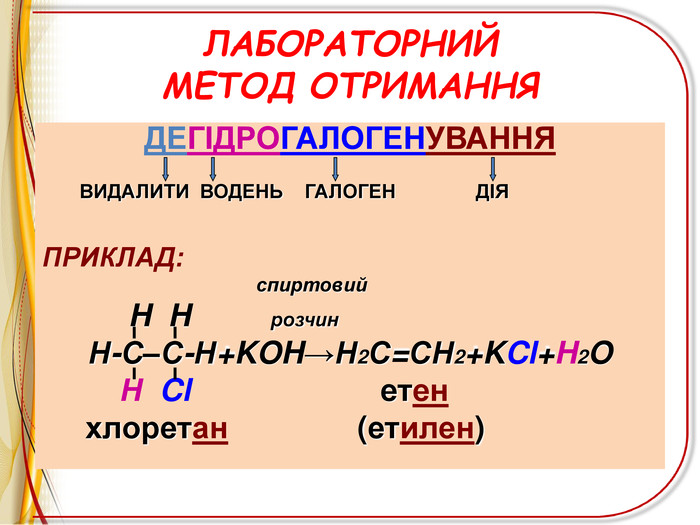

![РЕАКЦІЇ ОКИСНЕННЯ ЛЕГКЕ ОКИСНЕННЯ – ВЗАЄМОДІЯ З РОЗЧИНОМ ПЕРМАНГАНАТА КАЛІЯ (реакція Вагнера)Н2 С=СН2 + [O] + H2 O H2 C - CH2 OH OH етиленгліколь (етандіол-1,2) ! Якісна реакція на ненасиченість вуглеводню – на кратний зв’язок РЕАКЦІЇ ОКИСНЕННЯ ЛЕГКЕ ОКИСНЕННЯ – ВЗАЄМОДІЯ З РОЗЧИНОМ ПЕРМАНГАНАТА КАЛІЯ (реакція Вагнера)Н2 С=СН2 + [O] + H2 O H2 C - CH2 OH OH етиленгліколь (етандіол-1,2) ! Якісна реакція на ненасиченість вуглеводню – на кратний зв’язок](/uploads/files/6735/68312/72827_images/11.jpg)
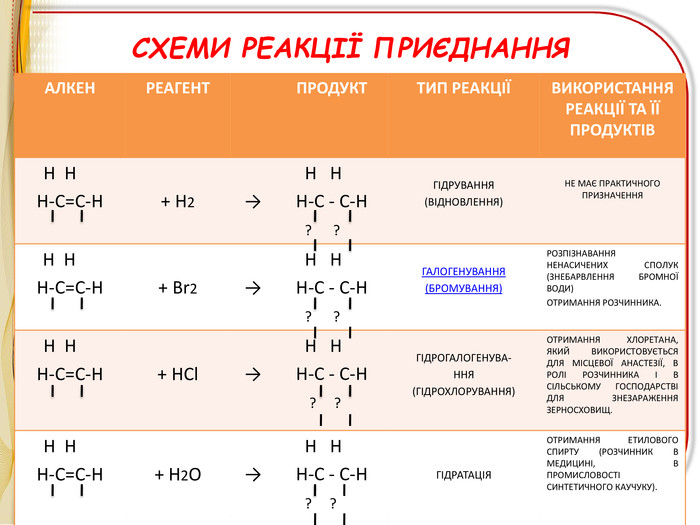





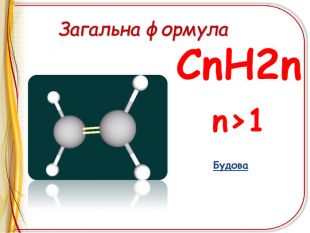







-

Юзьвяк Любов Михайлівна
07.11.2022 в 17:02
Дякую !
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Плодієнко Ольга Миколаївна
22.09.2022 в 14:34
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Обертінська Вікторія
05.10.2021 в 06:49
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
30.09.2021 в 07:39
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Руденко Людмила Леонідівна
13.11.2019 в 07:07
Дякую. Можливо і реакції приєднання розглядати окремо.
Загальна:
4.3
Структурованість
5.0
Оригінальність викладу
3.0
Відповідність темі
5.0
Показати ще 2 відгука