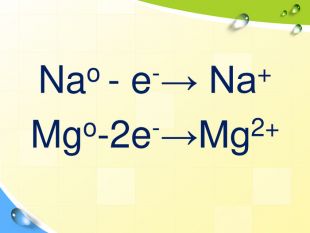Презентація на тему "Біогенні s-елементи, їхня біологічна роль та медичне застосування"
Про матеріал
Навчальна презентація, що розкриває поняття біогенних елементів, зокрема Натрію, Калію, Кальцію та Магнію, їх фізичні та хімічні властивості, поширення в природі та медичне значення. Перегляд файлу





![8. Кількість енергетичних підрівнів у Аргентуму відповідає 6.9. Назва сполуки [Сu(NH3)2(H2 O)4]SO4 диакватетраамінкупрум(ІІ) сульфат.10. До складу ферменту печінки аргінази, який каталізує розщеплення аргініну з утворенням сечовини входить Манган. 8. Кількість енергетичних підрівнів у Аргентуму відповідає 6.9. Назва сполуки [Сu(NH3)2(H2 O)4]SO4 диакватетраамінкупрум(ІІ) сульфат.10. До складу ферменту печінки аргінази, який каталізує розщеплення аргініну з утворенням сечовини входить Манган.](/uploads/files/461394/112168/119717_images/6.jpg)

![4. Карбоксигемоглобін – це сполука гемоглобіну із вуглекислим газом.5. До складу амінокислот цистеїн, цистин та метіонін входить хімічний елемент Сульфур.6. Кількість валентних електронів у Фосфору відповідає 6.7. Сполука [Fe(OH)2 (NH3)]Cl має назву: аміндигідроксиферум (ІІІ) хлорид. 4. Карбоксигемоглобін – це сполука гемоглобіну із вуглекислим газом.5. До складу амінокислот цистеїн, цистин та метіонін входить хімічний елемент Сульфур.6. Кількість валентних електронів у Фосфору відповідає 6.7. Сполука [Fe(OH)2 (NH3)]Cl має назву: аміндигідроксиферум (ІІІ) хлорид.](/uploads/files/461394/112168/119717_images/8.jpg)



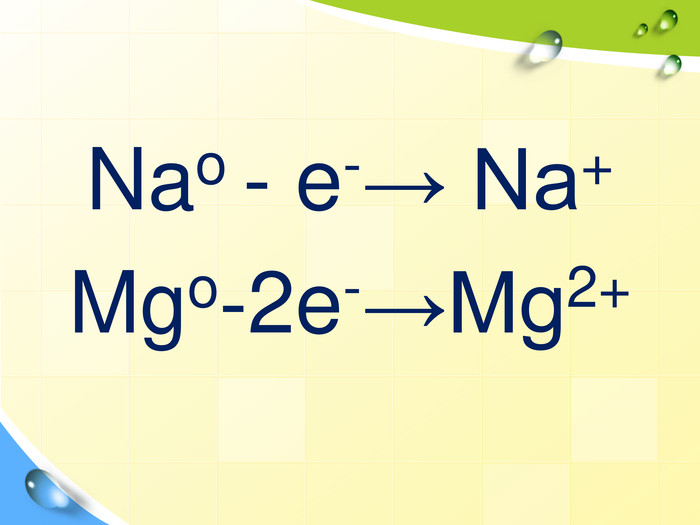


















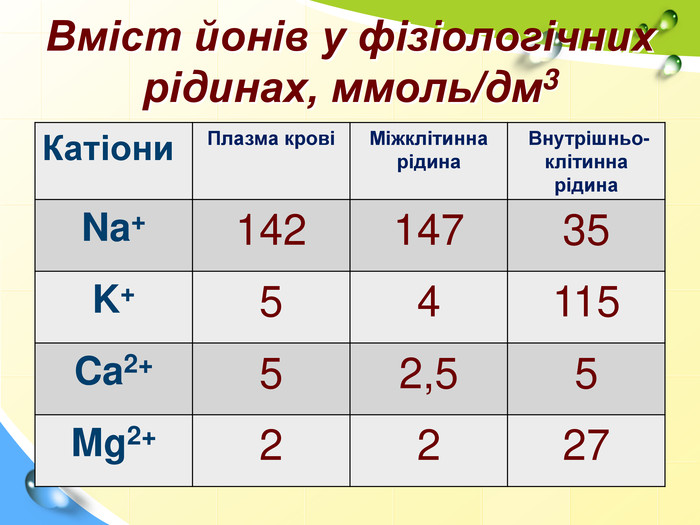

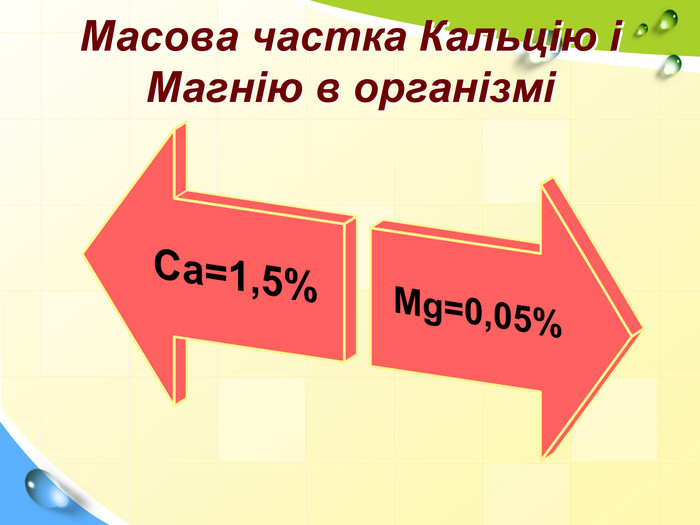
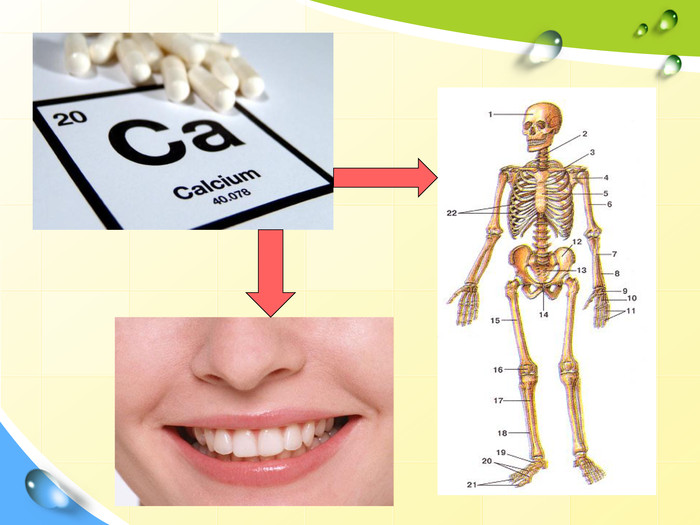
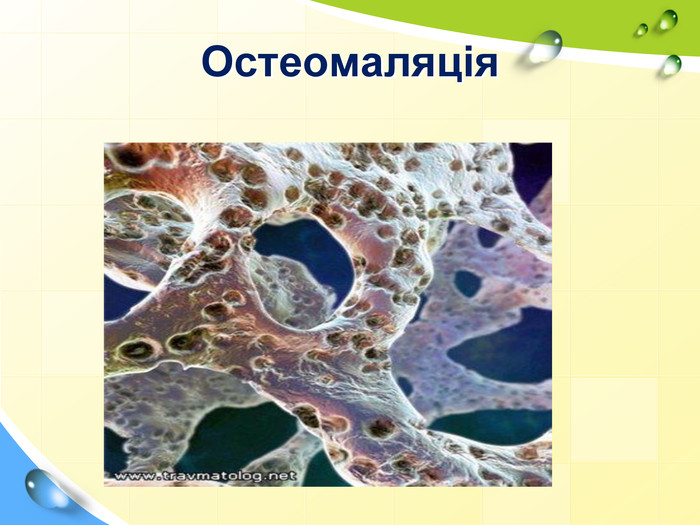




Зміст слайдів
Номер слайду 11
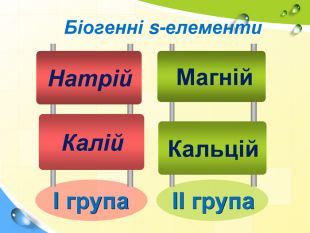
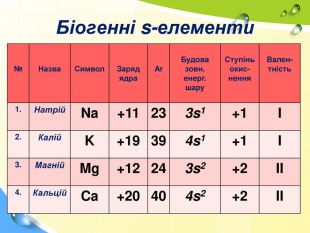
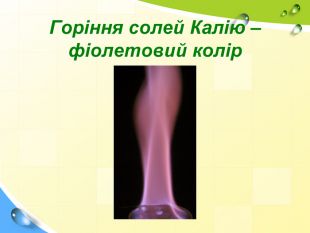
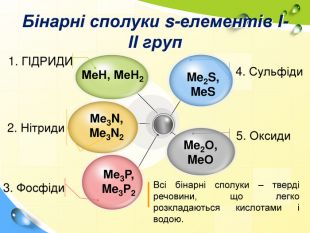
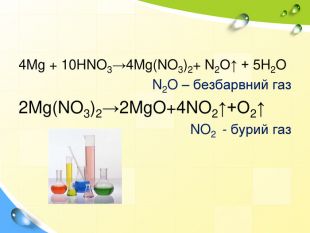
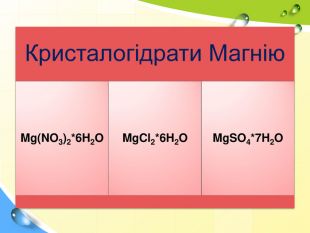
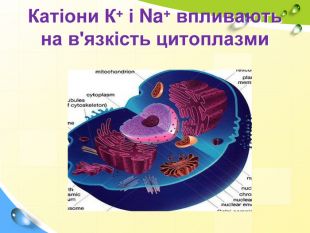
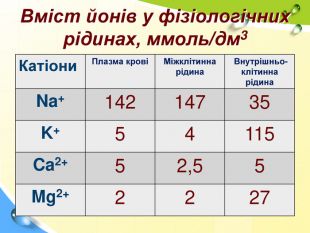
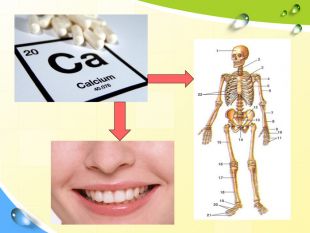
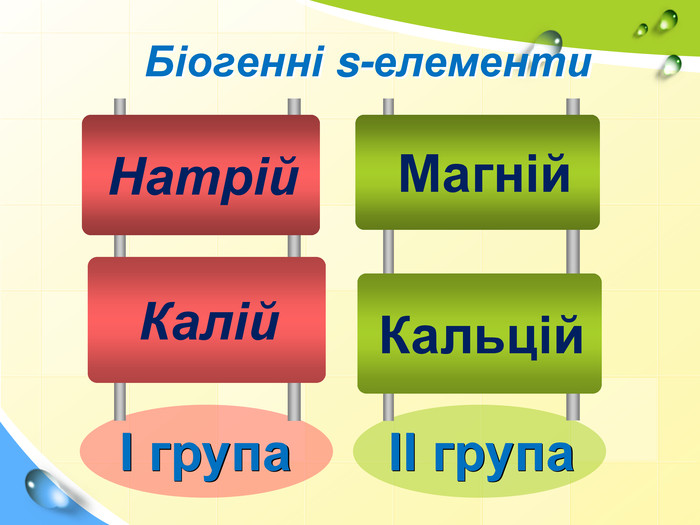
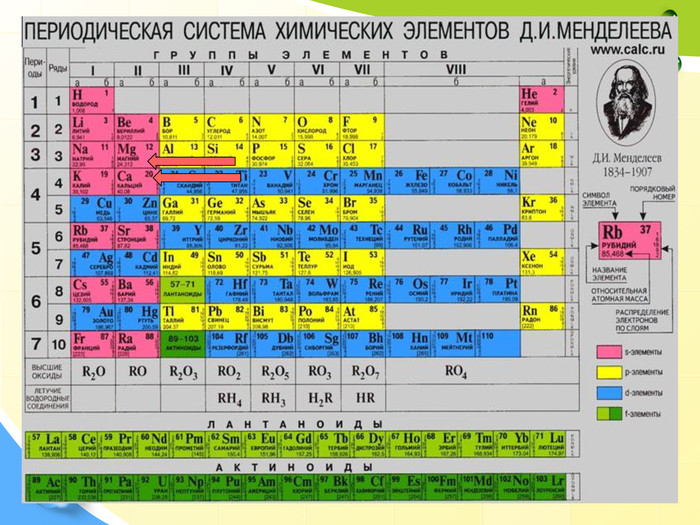
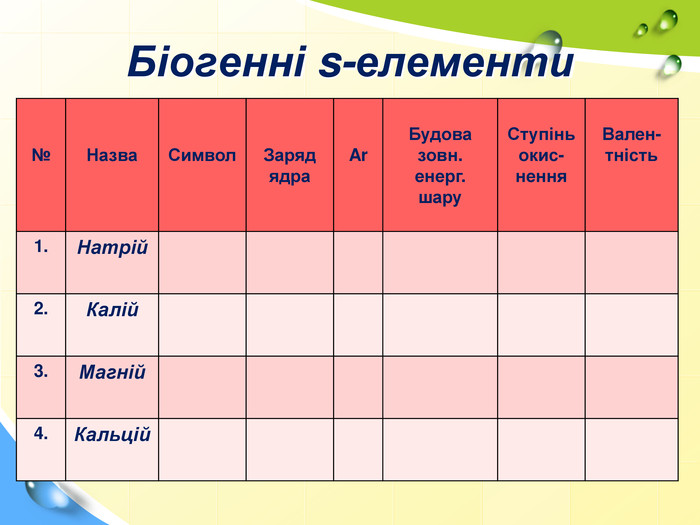
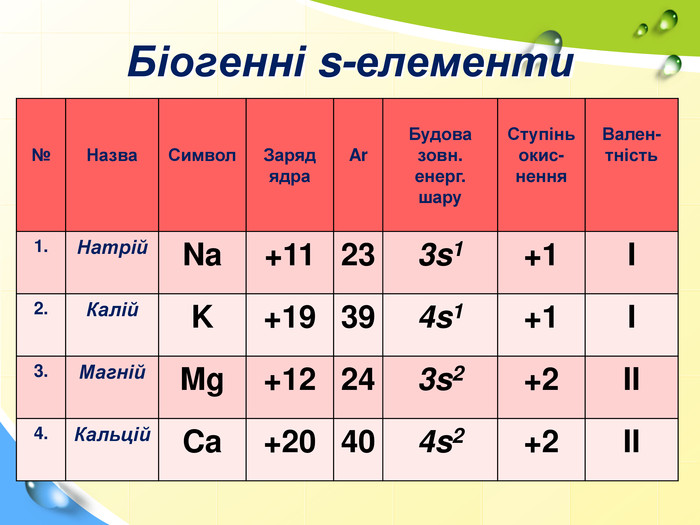
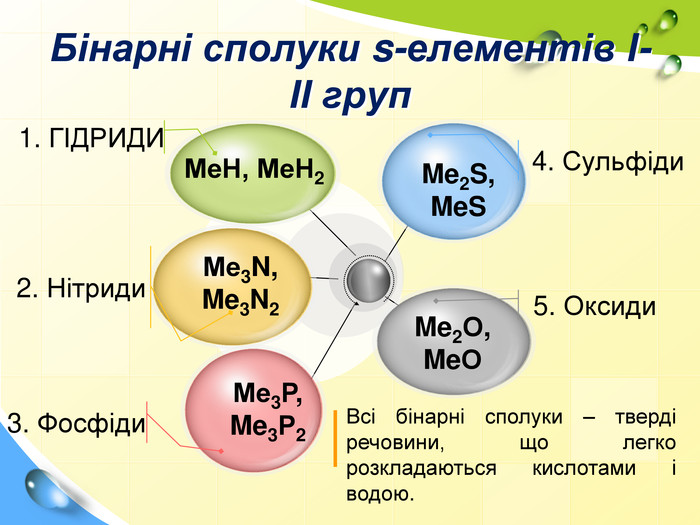
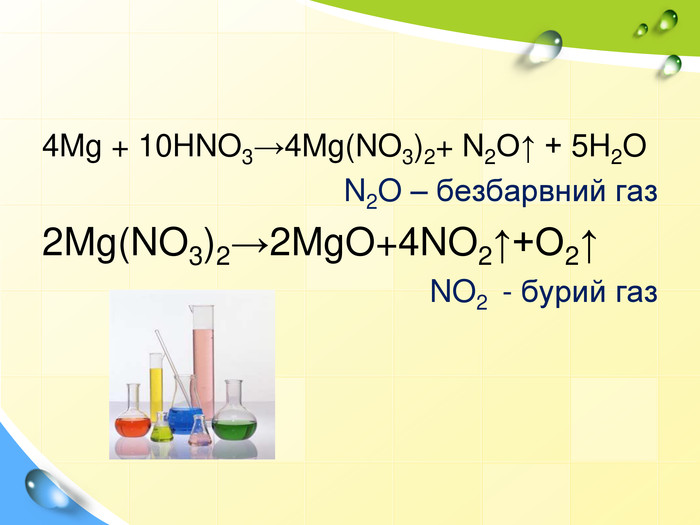
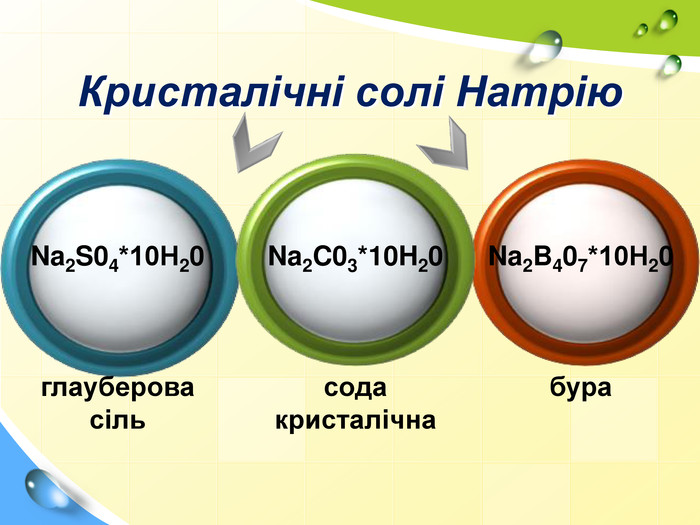
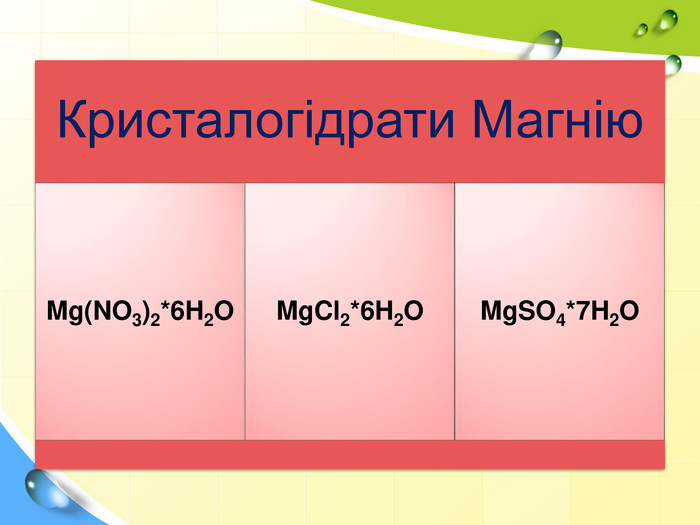
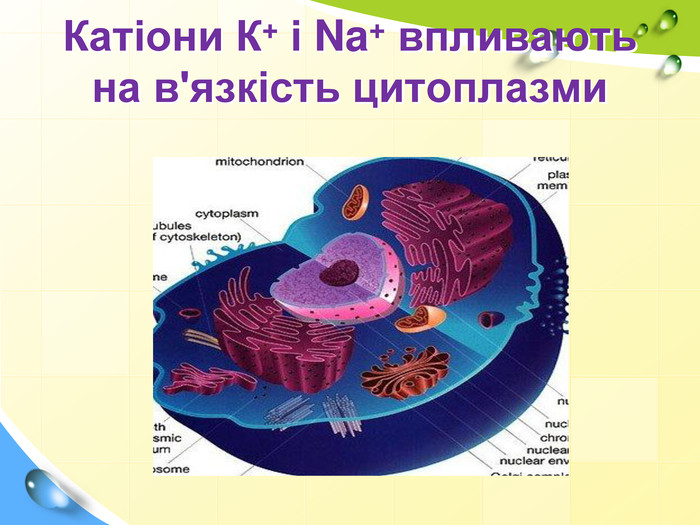
План 1. Загальна характеристика біогенних s-елементів.2. Хімічні властивості s-елементів та їх сполук:2.1. Бінарні сполуки s-елементів.2.2. Гідроксиди та солі лужних і лужноземельних металів.2.3. Кристалогідрати s-елементів.3. Біологічна роль s-елементів.4. Застосування деяких сполук s-елементів в медицині.
Номер слайду 50
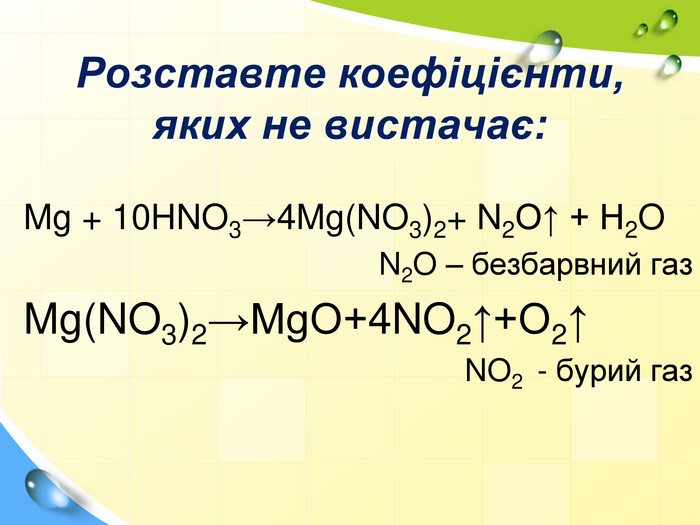
Домашнє завдання:(5-9 балів)Задачі: Визначте масову частку солі та води у бурі Na2 B4 O710 Н2 О. Скільки утвориться грам натрій хлориду, при взаємодії відповідного металу з 3,6 г хлоридної кислоти. Обчисліть масову частку солі Натрій хлориду в розчині, якщо до 200г 10% розчину цієї солі додали 100 мл води.
pptx
Додав(-ла)
Безпалько Олена Олександрівна
Додано
31 травня 2019
Переглядів
6966
Оцінка розробки
Відгуки відсутні


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
Рекомендовані матеріали
Схожі матеріали