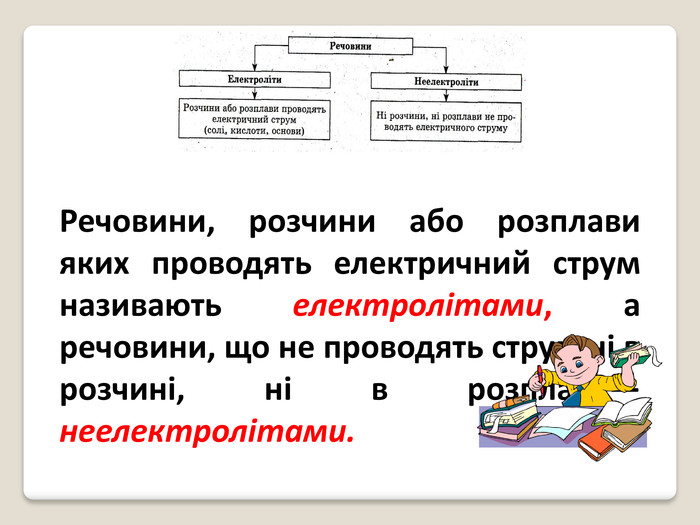
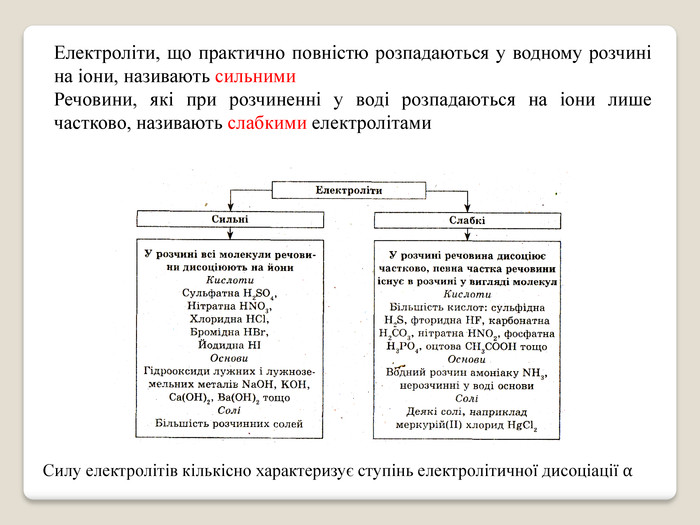
Презентація на тему: "Електролітична дисоціація"
Про матеріал
Загальна кількість слайдів презентації - 15. Містить чотири відео досдідів, які наочно ознайомлюоть учнів із явищем дисоціації та її залежністю від різних чинників. Ознайолює учня з поняттям електролітів та їх класифікацією. Також до презентації входять два завдання. Дана презентація може використовуватись на уроці для наочності. Зміст архіву
Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку