Презентація на тему: "Фосфор. Сполуки фосфору"
Про матеріал
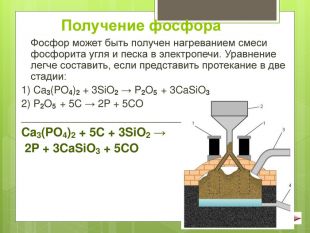
Матеріал використовується при вивченні теми " Фосфор. Сполуки фосфору" на поглибленому та профільному рівні в 10 класі. В матеріалі наведені хімічні рівняння, що характеризують хімічні властивості фосфору, його оксидів, леткої водневої сполуки та фосфорної кислоти.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
-
А якою мовою веде уроки вчитель, який зробив цю презентацію? Безграмотно навіть там, де українською.
ppt
До підручника
Хімія (профільний рівень) 10 клас (Буринська Н.М. та інші)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку