Презентація на тему "Насичені й ароматичні аміни"












• Амоніак добре розчинний у воді, його водний розчин має лужне середовище. Пояснюється це тим, що між амоніаком і водою відбувається взаємодія, яку можна описати таким молекулярним рівнянням реакції:• Амоній гідроксид належить до слабких електролітів, його дисоціація відбувається за рівнянням:• Вода є дуже слабким електролітом, але в рідкому агрегатному стані дуже незначна частина її молекул дисоціює на катіони Гідрогену й гідроксид-аніони:
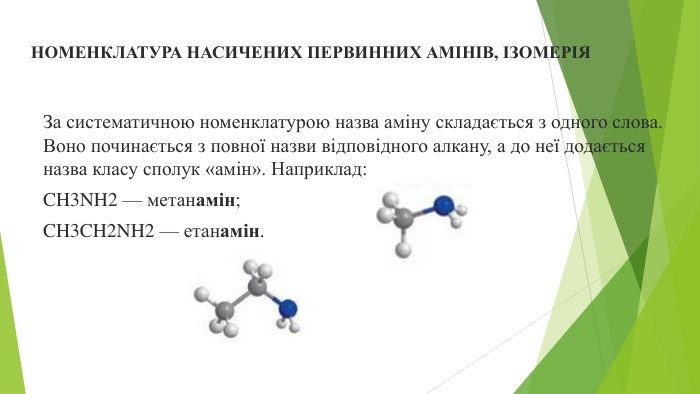
ПОНЯТТЯ ПРО АМІНИ, ЇХ СКЛАД І БУДОВУЗа якісним складом — це нітрогеновмісні органічні сполуки, молекули яких містять атоми Карбону, Гідрогену й Нітрогену. Карбон входить до складу вуглеводневого залишку, Нітроген — до складу характеристичної аміногрупи —NH2, Гідроген — до обох складових частин молекули. Назва «аміни» утворена від назви «амоніак». Цей клас сполук розглядають як похідні амоніаку NH3, у молекулі якого один, два або три атоми Гідрогену заміщені вуглеводневими залишками, наприклад, метанамін СН3—NH2, метилметанамін (СН3)2 — NH, диметилметанамін (СН3)3 — N. У всіх амінів, подібно до амоніаку, в атома Нітрогену є вільна електронна пара. Завдяки вільній електронній парі аміни вступають у реакції з водою й кислотами. Аміни — нітрогеновмісні органічні речовини, похідні амоніаку, молекули яких складаються з вуглеводневого залишку й характеристичної аміногрупи —NH2.
КЛАСИФІКАЦІЇ Й ЗАГАЛЬНІ ФОРМУЛИ АМІНІВЗалежно від природи вуглеводневих замісників розрізняють насичені аміни (аміногрупа сполучена із залишком алкану) й ароматичні аміни (аміногрупа сполучена із залишком арену), наприклад: Кількість вуглеводневих залишків у молекулі служить ще однією класифікаційною характеристикою амінів, за якою їх поділяють на первинні, вторинні й третинні:
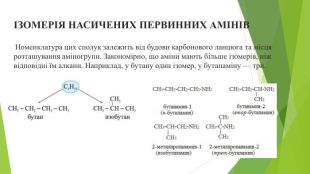
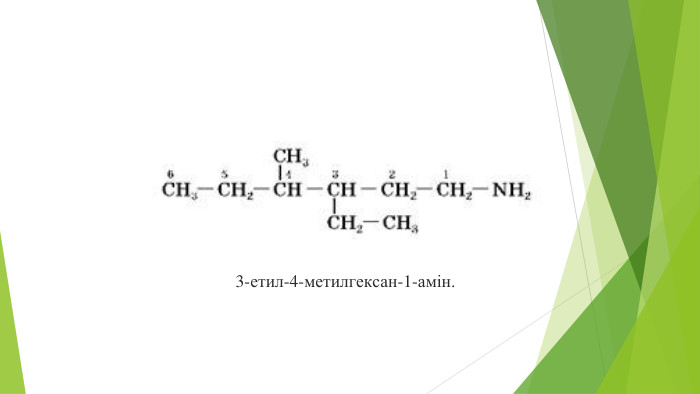
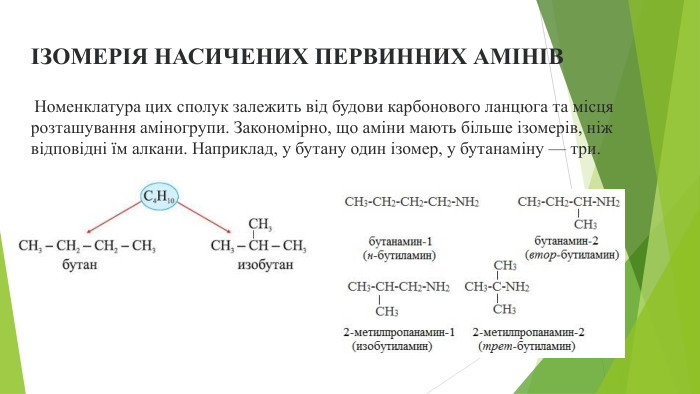
Для того щоб назвати насичений первинний амін з розгалуженим вуглеводневим замісником, дотримуються таких правил.1. Обирають головний (найдовший) карбоновий ланцюг, у якому один з атомів Карбону сполучений з аміногрупою.2. Нумерують головний ланцюг за принципом найменшого локанта аміногрупи.3. З'ясовують наявність у головному ланцюзі вуглеводневих замісників і їх назви.4. Складають назву речовини в такій послідовності:називають в алфавітному порядку вуглеводневі замісники (у разі їх наявності в головному ланцюзі), указуючи перед назвами їх локанти, які виділяють дефісами. До однакових замісників уживають множинні префікси ди-, три-, тетра-;називають алкан головного ланцюга;після назви головного ланцюга записують, виділяючи з обох боків дефісами, локант аміногрупи;додають назву класу цих сполук — «амін».
ХІМІЧНІ ВЛАСТИВОСТІ НАСИЧЕНИХ АМІНІВ НА ПРИКЛАДІ МЕТАНАМІНУ.1. Горіння амінів. Аміни згорають у повітрі з утворенням азоту, карбон(IV) оксиду та води:2. Взаємодія з водою. Подібно до амоніаку, розчинні у воді аміни виявляють основні властивості. Так, під час реакції з водою до аміну приєднується протон Н+ і вивільнюється аніон ОН-, утворений унаслідок електролітичної дисоціації води. Це відбувається за рахунок вільної електронної пари атома Нітрогену: Варто зазначити, що метанамін є сильнішою основою, ніж амоній гідроксид NH4 OH. І в цьому разі підтверджується положення теорії будови органічних сполук про взаємний вплив атомів і груп атомів у молекулі.
АНІЛІН, АБО ФЕНІЛАМІНЦе ароматичний амін з молекулярною формулою C6 H5 NH2. Його називають феніламін за назвою замісника —С6 Н5. Молекулярна формула цієї речовини вказує на те, що аміногрупа сполучена з атомом Карбону бензенового кільця (у бензені відбулася заміна одного атома Гідрогену на одновалентну аміногрупу). Анілін — безбарвна (темніє на світлі й у повітрі) оліїста речовина, що важко розчиняється у воді, має специфічний запах. Пари аніліну отруйні.
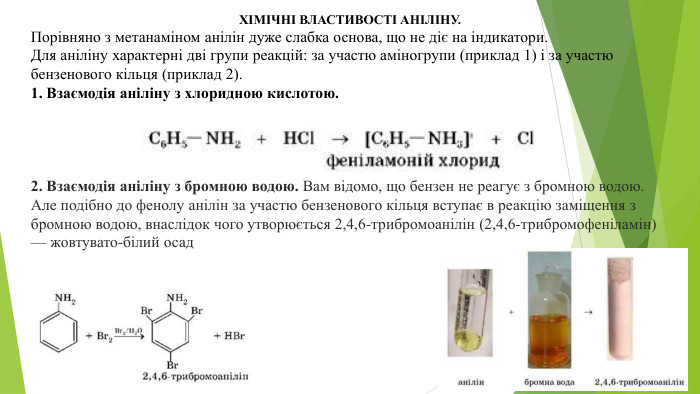
ХІМІЧНІ ВЛАСТИВОСТІ АНІЛІНУ. Порівняно з метанаміном анілін дуже слабка основа, що не діє на індикатори. Для аніліну характерні дві групи реакцій: за участю аміногрупи (приклад 1) і за участю бензенового кільця (приклад 2).1. Взаємодія аніліну з хлоридною кислотою.2. Взаємодія аніліну з бромною водою. Вам відомо, що бензен не реагує з бромною водою. Але подібно до фенолу анілін за участю бензенового кільця вступає в реакцію заміщення з бромною водою, внаслідок чого утворюється 2,4,6-трибромоанілін (2,4,6-трибромофеніламін) — жовтувато-білий осад
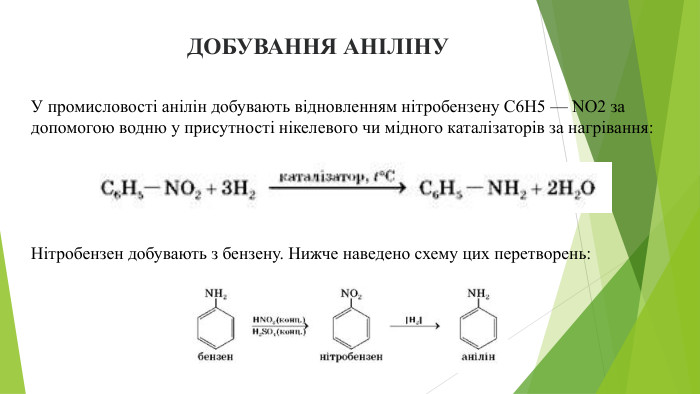
ЗАСТОСУВАННЯ АНІЛІНУ. Понад 150 років анілін виробляють у великій кількості, тому що ця речовина — основа синтезу анілінових барвників, які використовують для фарбування тканин у різні яскраві кольори. Анілінові барвники можна придбати у вигляді порошку або рідини й за потреби використати в домашніх умовах. Водночас у разі перевищення допустимих норм використання, вплив аніліну та його похідних для довкілля негативний. Анілін — сировина для синтезу ліків, наприклад стрептоциду, який має ефективну антимікробну дію; фунгіцидів (препаратів для боротьби з грибковими захворюваннями рослин) та ін.


про публікацію авторської розробки
Додати розробку