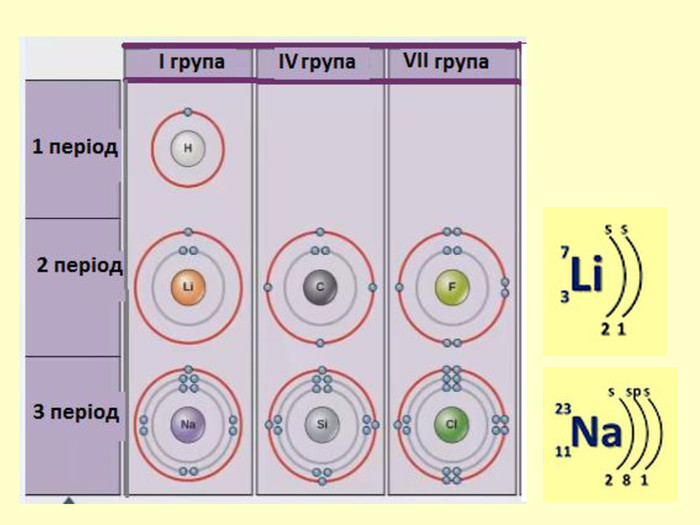
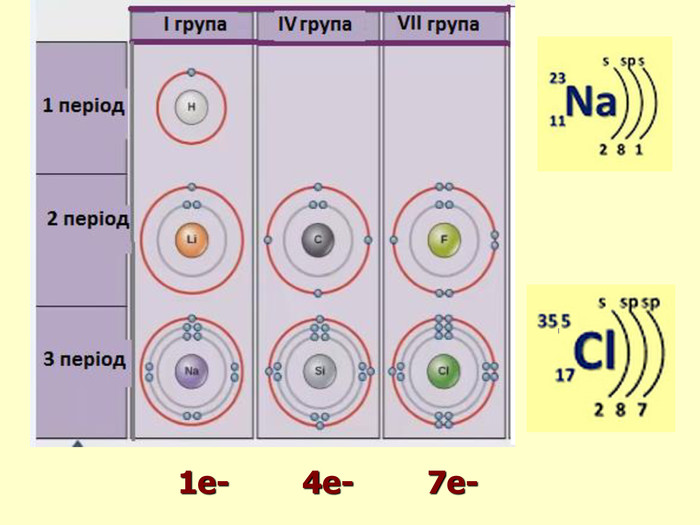
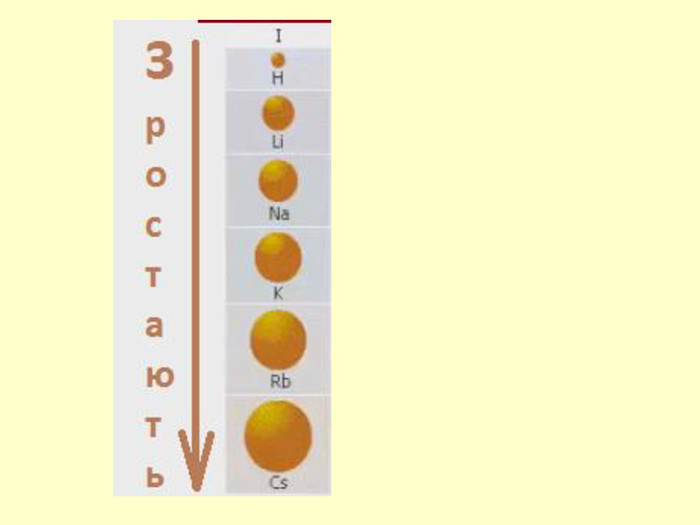
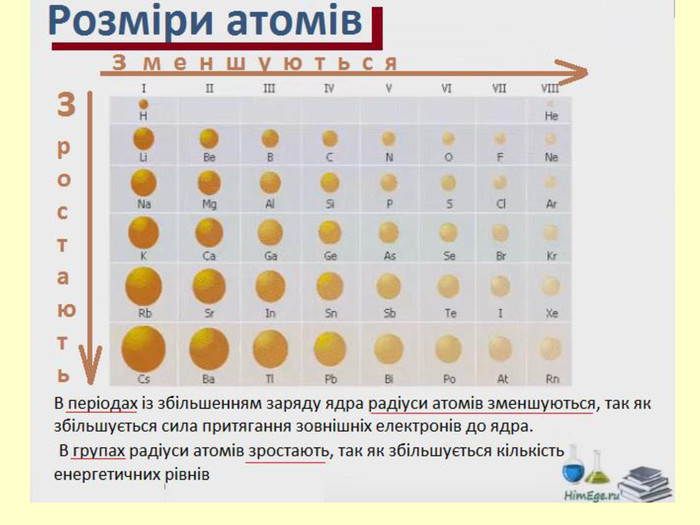
Презентація на тему "Періодичний закон і періодична система елементів Д.І.Менделєєва"
Про матеріал
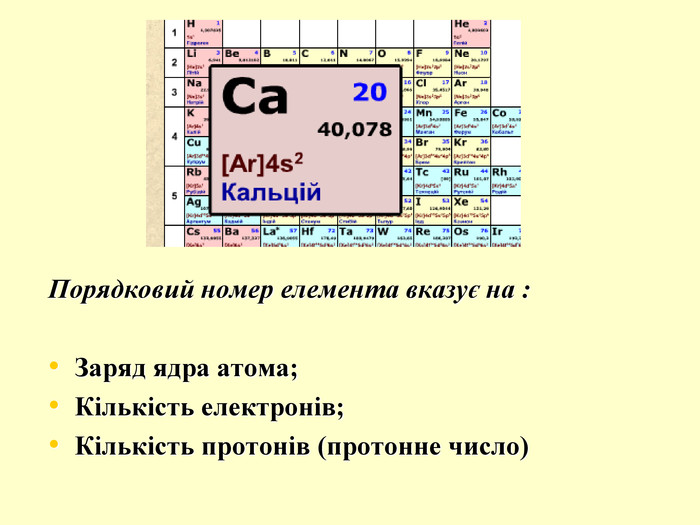
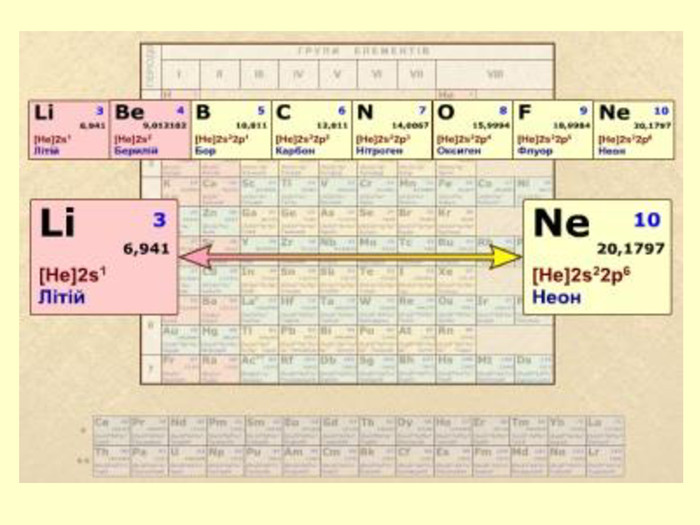
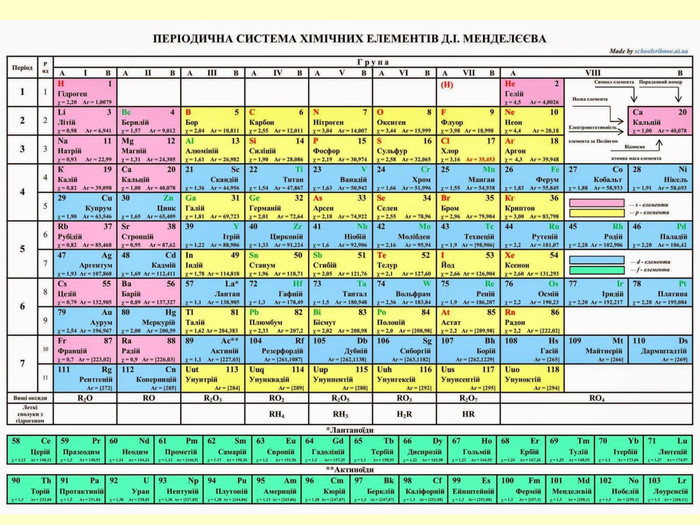
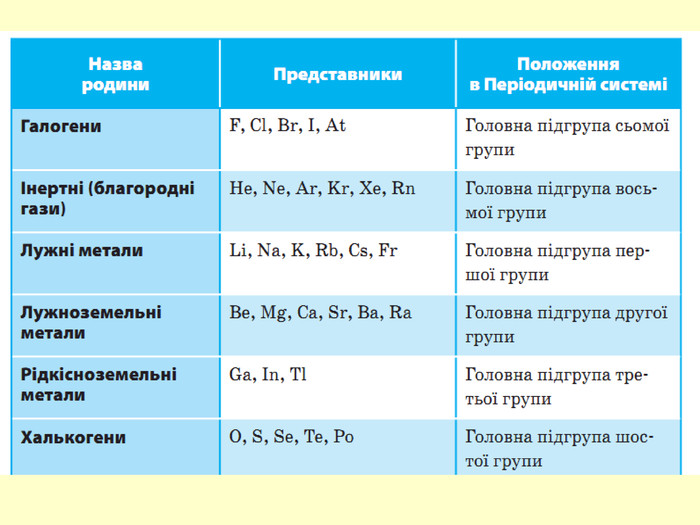
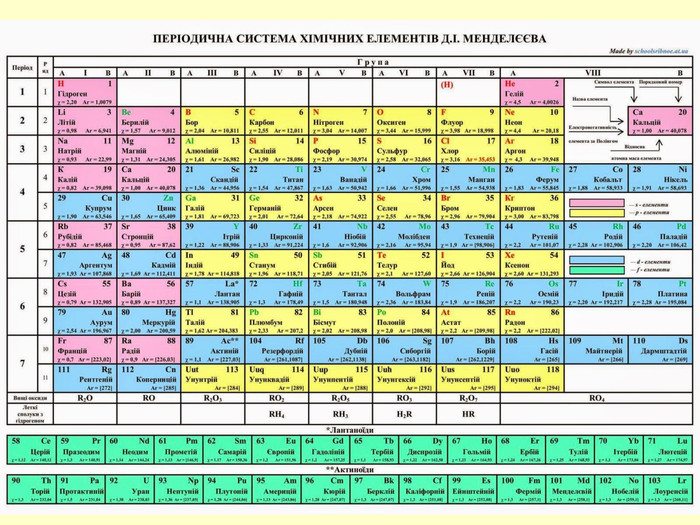
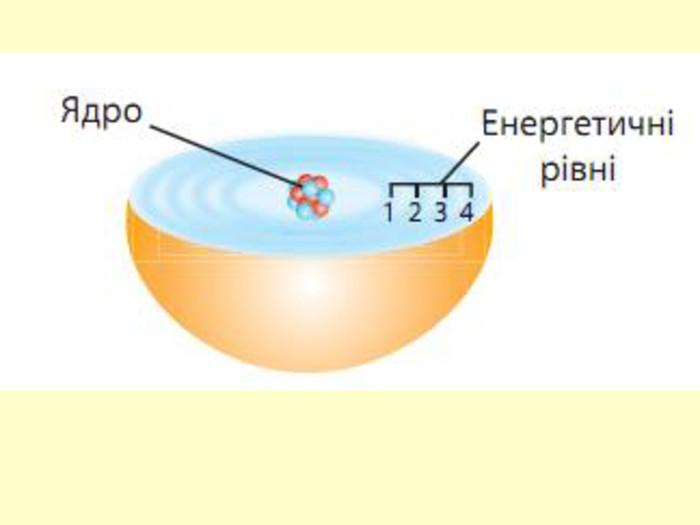
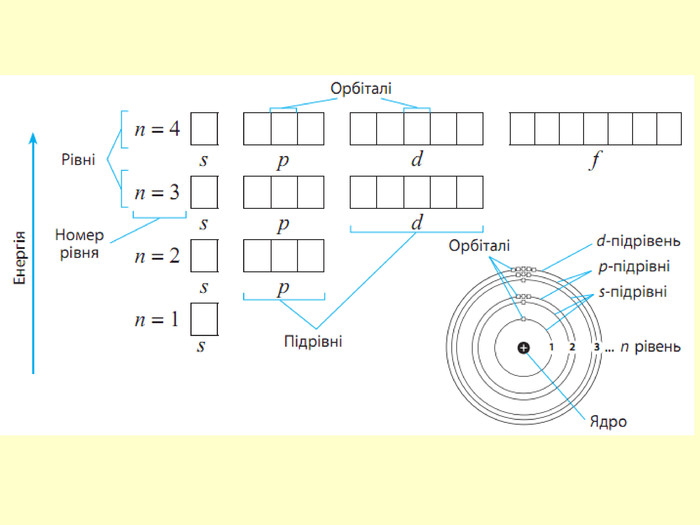
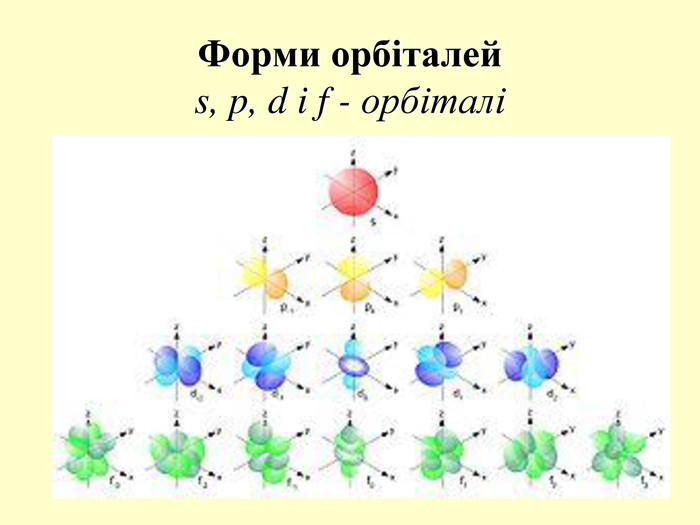
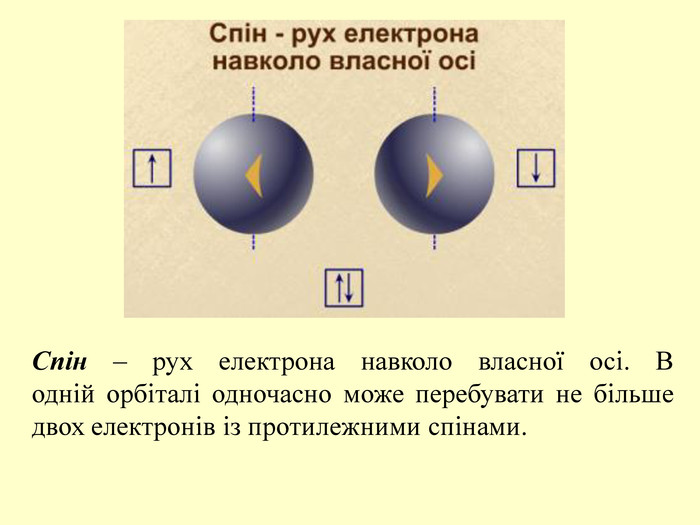
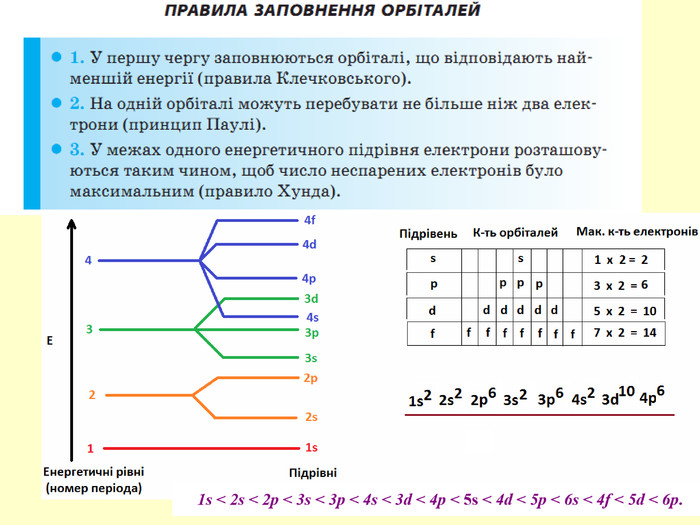
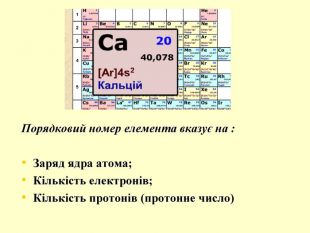
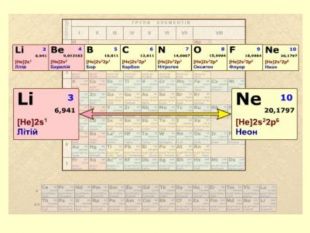
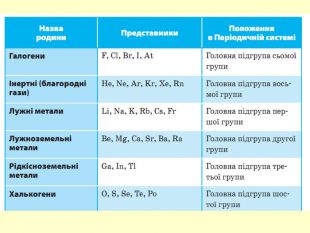
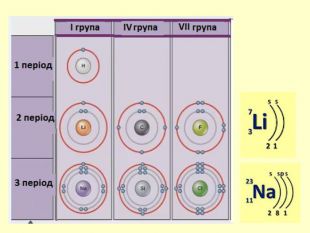
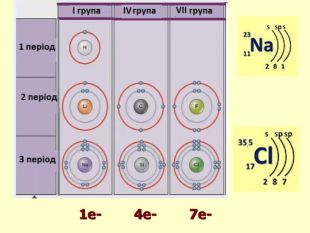
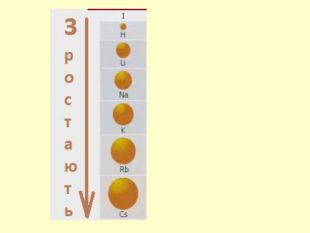
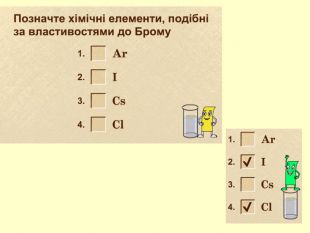
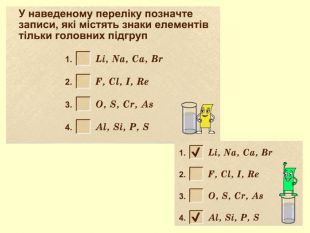
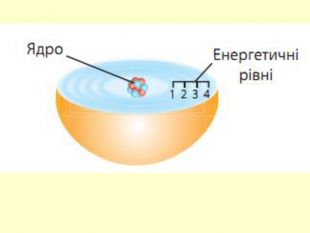
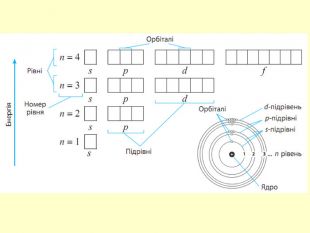
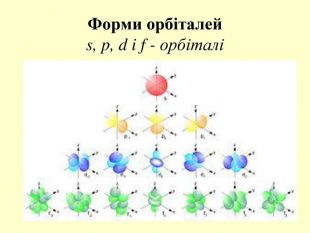
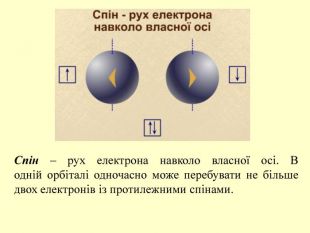
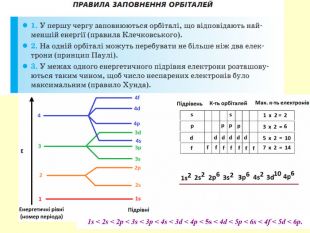
повторити і систематизувати знання про періодичність зміни властивостей хімічних елементів; про структуру періодичної системи, про періоди й групи; виявити зв'язок між положенням елемента в періодичній системі та його властивостями; обговорюючи відкриття періодичного закону, підвести до глибшого осмислення явища періодичності; дати поняття про структурні одиниці періодичної системи.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
ppt
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку