Урок "Алюміній" (хімія металів)
актуалізувати знання про металічні елементи, будову їхніх атомів; схарактеризувати поширення Алюмінію в природі, фізичні й хімічні властивості його простої речовини; обгрунтувати спосіб добування і застосування алюмінію його властивостями.
Міністерство освіти і науки України
Дрогобицький нафтовий коледж
Конспект лекції
з предмету Х І М І Я
Тема заняття : 3.4 „Алюміній”
Методична мета : актуалізувати знання студентів про металічні елементи, будову їхніх атомів.
Схарактеризувати поширення Алюмінію в природі, фізичні й хімічні властивості
його простої речовини. Обгрунтувати спосіб добування і застосування алюмінію
його властивостями.
Викладач:______________________________ Богак Л.Р.
Дрогобич
|
Тема заняття:
Вид заняття:
Мета заняття:
Базові поняття й терміни:
Внутрішні зв’язки:
Забезпечення заняття:
Література:
|
„Алюміній”
лекція
Навчальна: актуалізувати знання студентів про металічні елементи, будову їхніх атомів; схарактеризувати поширення Алюмінію в природі, фізичні й хімічні властивості його простої речовини; обгрунтувати спосіб добування і застосування алюмінію його властивостями. Розвиваюча: розвивати інтелектуальні можливості та пізнавальну активність студентів на занятті, формувати в них зацікавленість до вивчення предмету.
Виховна: орієнтувати студентів на можливість практичного застосування знань та вмінь з предмету в їх майбутній трудовій діяльності.
Метали, електронна оболонка
Роздатковий матеріал: роздатковий (ілюстрацій ний) матеріал для студентів
Наочність: мультимедійна підтримка заняття.
В.П. Басов, В.М.Фодіонов Хімія, Навчальний посібник, 4 видання Київ „Каравела”, 2004, 320 с. Н.М.Буринська Хімія 8 клас , Київ „Ірпінь”, 2000, 158с. Н.М.Буринська, Л.П. Величко Хімія 10 клас , Київ „Ірпінь”, 2000, 172с. Н.В.Романова Загальна та неорганічна хімія:Підручник для студентів-Київ; Ірпінь:ВТФ „Перун”, 1998.-480с.
|
ПЛАН ЗАНЯТТЯ
|
Тема : |
„Алюміній” |
|
Вид заняття : |
лекція |
|
Мета : |
Навчальна актуалізувати знання студентів про металічні елементи, будову їхніх атомів; схарактеризувати поширення Алюмінію в природі, фізичні й хімічні властивості його простої речовини; обгрунтувати спосіб добування і застосування алюмінію його властивостями. Розвиваюча: розвивати інтелектуальні можливості та пізнавальну активність студентів на занятті, формувати в них зацікавленість до вивчення предмету.
|
|
|
Виховна орієнтувати студентів на можливість практичного застосування знань та вмінь з предмету в їх майбутній трудовій діяльності.
|
|
Забезпечення заняття : |
Роздатковий матеріал: роздатковий (ілюстрацій ний) матеріал для студентів Наочність: мультимедійна підтримка заняття.
|
|
|
|
|
|
|
Х І Д З А Н Я Т Т Я
1 Організаційна частина
2 Повідомлення теми, плану та мети заняття
2.1 Положення Алюмінію у періодичній системі та будова його атома.
2.2 Фізичні властивості алюмінію. Поширення Алюмінію у природі.
2.3 Хімічні властивості алюмінію.
2.4 Застосування алюмінію.
3 Мотивація навчальної діяльності студентів, постановка проблемних питань
4 Актуалізація опорних знань (буде проведена у продовж всього заняття)
5 Вивчення нового матеріалу
- Підведення підсумків заняття
- Домашнє завдання (короткі конспекти лекцій)
Х І Д З А Н Я Т Т Я
Актуалізація опорних знань
І Фронтальне опитування:
- Які елементи називають амфотерними?
- Яким кольором амфотерні елементи зображені у ПС?
- Які основні фізичні й хімічні властивості характерні для металів?
- Чому більшість металів, які довгий час перебували на повітрі, втрачають металевий блиск?
1 Положення Алюмінію у періодичній системі та будова його атома
Широко розповсюджений метал алюміній відомий людству здавна. Так, наприклад, римському імператору Тіберію (14-27р.н.е.), була подарована алюмінієва чаша, яка була схожа на срібну, однак важила вона значно менше.


Ганс Крістіа́н Ерсте́д
Алюміній довший час вважався «дорогоцінним» металом. Алюмінієві злитки були представлені на міжнародних ювелірних виставках, використовувались для оформлення пам’ятників. Для порівняння: 120 років назад фунт алюмінію коштував 12 доларів, а фунт срібла – 15 доларів. Причина – складність добування мінералів та виділення із них алюмінію.
- Виходячи з положення у періодичній системі хімічних елементів, охарактеризуйте Алюміній. (студенти самостійно дають характеристику АІ та записують його електронну формулу )
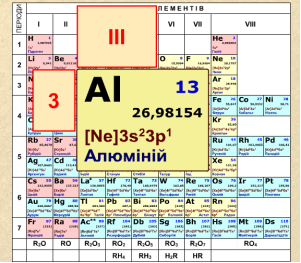

Алюміній знаходиться в ІІІ групі головній підгрупі, належить до 3 періоду. Порядковий номер 13. На зовнішньому енергетичному рівні міститься 3 електрони: 2 спарених s-електрони й 1 неспарений р-електрон. У своїх сполуках АІ завжди тривалентний, тобто незбуджений стан для нього нехарактерний.

Під час утворення хімічних сполук атом Алюмінію віддає усі зовнішні електрони і проявляє ступінь окиснення +3.
У елементів третьої групи головної підгрупи металічні властивості виражені слабше, ніж в елементів ІІ групи головної підгрупи. Перший елемент ІІІ групи – Бор, появляє вже неметалічні властивості. Із зростанням числа енергетичних рівнів металічні властивості цієї групи посилюються.
 2 Фізичні властивості алюмінію
2 Фізичні властивості алюмінію

Поширення Алюмінію у природі
Відомо приблизно 250 мінералів Алюмінію. Цей хімічний елемент входить до складу алюмосилікатів. До них належать: слюди, польові шпати, глини, зокрема каолін. Багаті на алюміній також алуніт (галуновий камінь) К2SО4 · А12(SО4)3 · 4А1(ОН)3, нефелін, альбіт Na2O · Al2O3 · 6SiO2, кріоліт Na3[AlF6], боксит.
Мінерал корунд – це кристалічний алюміній оксид Al2O3. Його синій різновид, який містить домішки Титану й Феруму, називають сапфіром. Червоний колір іншого різновиду – рубіну – зумовлений домішками Хрому.



Різні домішки здатні надавати так званому шляхетному корундові зеленого, жовтого, жовтогарячого, фіолетового та інших кольорів й відтінків.

Шпінель Al2O3 · MgO також містить Алюміній і не поступається красою рубінам. З ними часто плутали шляхетну рубінову шпінель. Два знаменитих історичних камені зі скарбів британської корони (“Рубін Чорного Принца” і “Рубін Тимура”) виявилися червоною шпінеллю. Подібна рубінова шпінель масою 398,72 карата вінчає корону Російської імперії.



Атомна частка Алюмінію в земній корі становить 6,4%.
Ознайомтеся за таблицею з масовими частками Алюмінію в різних природних об’єктах:
|
Масова частка Алюмінію, % |
|||
|
Земна кора |
Морська вода |
Рослини |
Тварини |
|
8,5 |
1·10 -6 |
0,02 |
1·10 -5 |
Порівняйте вміст Алюмінію в земній корі та морській воді, в рослинних і тваринних організмах.
У живих організмах Алюміній не виконує жодної фізіологічної функції, однак через його поширеність входить до складу живої речовини. Перші відомості про токсичність сполук Алюмінію були отримані лише в 70-х роках минулого століття. Накопичення Алюмінію в організмі супроводжується збільшенням крихкості кісток, розвитком різних форм анемії, порушенням мови, провалами пам’яті, помутнінням розуму, конвульсіями. Підвищення вмісту катіонів Алюмінію призводить до загибелі риб, земноводних і молюсків у водоймах.
Особливі властивості алюмінію:
- Стійкість до ржавіння за рахунок покриття металу на повітрі тонкою, міцною, безбарвною оксидною плівкою;
- Здатність «притягувати» Оксиген із оксидів інших металів;
- Висока розчинність в розбавлених мінеральних кислотах з утворенням солей, однак не взаємодіє з органічними кислотами та нітратною к-тою;
- Висока стійкість кристалічного оксиду алюмінію – корунду – до дії кислот та лугів;
- Висока пластичність;
- Здатність до механічної обробки – ковка, прокатка, штамповка, полірування, пресування, волочіння, а також до зварки – газової, контактної;
- Стійкість до дії морської та прісної води.
3 Хімічні властивості алюмінію
1 Хімічно алюміній дуже активний, однак досить тонка й міцна оксидна плівка зумовлює корозійну стійкість алюмінію. За нагрівання на повітрі чи в кисні алюміній згоряє:
4Al + 3O2 → 2Al2O3
 Перетворіть схему реакції горіння алюмінію на хімічне рівняння. Визначте окисник і відновник (самостійна робота студентів на парі)
Перетворіть схему реакції горіння алюмінію на хімічне рівняння. Визначте окисник і відновник (самостійна робота студентів на парі)





5 За нагрівання алюміній реагує з сіркою, азотом, вуглецем:
2Al + N2 → 2AlN 2Al + 3S → Al2S3 4Al + 3C → Al4C3
Перетворіть схеми реакцій алюмінію з цими неметалами на хімічні рівняння. Визначте, окисником чи відновником є алюміній у цих реакціях (самостійна робота студентів на парі)
6 Концентровані сульфатна і нітратна кислоти пасивують алюміній. Натомість із розбавленими хлоридною та сульфатною кислотами алюміній реагує досить активно:
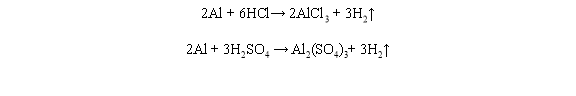

Перетворіть схеми реакцій алюмінію з цими неметалами на хімічні рівняння. Визначте, окисником чи відновником є алюміній у цих реакціях (самостійна робота студентів на парі)
7 Алюміній відновлює метали з їхніх оксидів. Пригадайте, як називають цей спосіб добування металів
4 Застосування алюмінію










Алюміній і його сплави (дюралюміній і силумін) використовують практично у всіх галузях сучасної техніки. Основними споживачами алюмінію та його сплавів є: авіаційна й автомобільна промисловості, залізничний і водний транспорт, машинобудування тощо.
Самостійна робота студентів під час вивчення
теми: «Алюміній»
Самостійна робота студентів на парі:
- Виходячи з положення у періодичній системі хімічних елементів, охарактеризуйте Алюміній. (студенти самостійно дають характеристику АІ та записують його електронну формулу )
- Перетворіть схему реакції на хімічне рівняння. Визначте окисник і відновник (студенти самостійно складають електронний баланс, визначають окисник та відновник, урівнюють рівняння реакції)
Al + O2 → Al2O3
Al + Сl2 → AlСl3
Al + Br2 → AlBr3
Al + I2 → AlІ3
Al + N2 → AlN Al + S → Al2S3 Al + C → Al4C3
Al + Н2О→ Al(ОН)3↓ + Н2↑
Al + НСl→ AlCl3 + Н2↑
Al + Н2SО4 → Al2(SO4)3+ Н2↑
- Використовучи роздатковий матеріал зробити короткий конспект:
- фізичних властивостей Алюмнію;
- поширення Алюмінію у природі;
- застосування Алюмінію.

про публікацію авторської розробки
Додати розробку
