Презентація на тему: "Перші способи класифікації хімічних елементів".












Перші способи класифікації хімічних елементів У кожній науці існує певна класифікація понять, явищ, систем. Без цього наука розвивається хаотично, в ній панує безлад. Зусиллями К. Ліннея класифікавано рослин: Жан Батист Ламарк запроаонував класифіквцію тварин: проблема класифікації хімічних елементів гостро постала перед хіміками XIX століття.
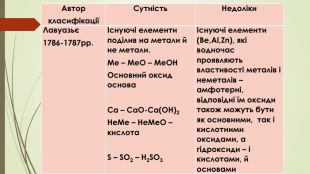
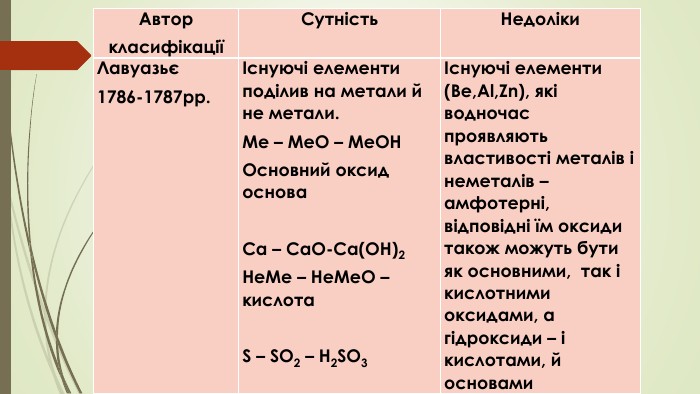
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}АвторкласифікаціїСутність. Недоліки. Лавуазьє1786-1787рр.Існуючі елементи поділив на метали й не метали. Me – Me. O – Me. OHОсновний оксид основа Ca – Ca. O-Ca(OH)2 He. Me – He. Me. O – кислота S – SO2 – H2 SO3Існуючі елементи (Be,Al,Zn), які водночас проявляють властивості металів і неметалів – амфотерні, відповідні їм оксиди також можуть бути як основними, так і кислотними оксидами, а гідроксиди – і кислотами, й основами
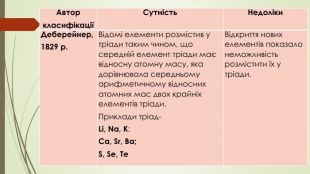
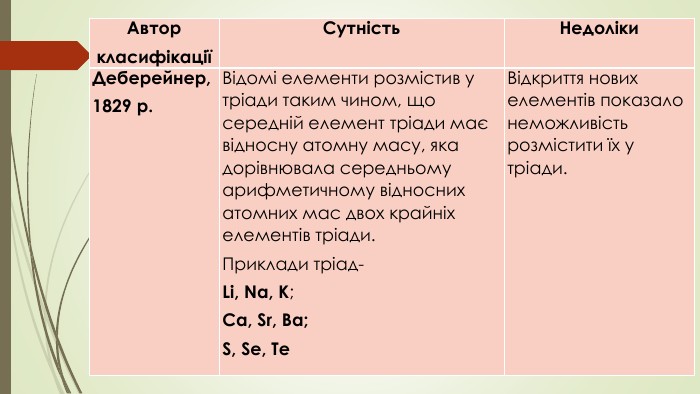
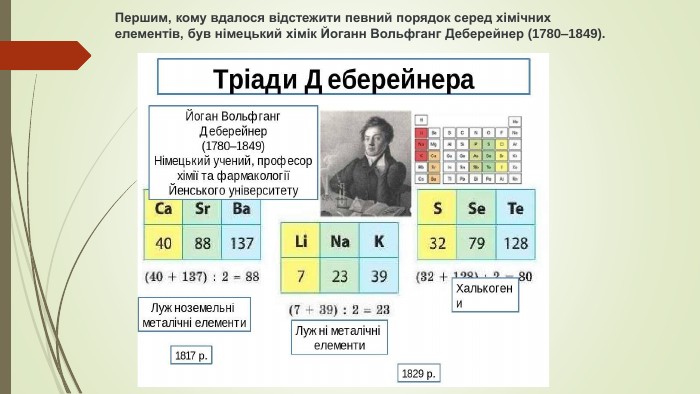
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}АвторкласифікаціїСутність. Недоліки. Деберейнер,1829 р. Відомі елементи розмістив у тріади таким чином, що середній елемент тріади має відносну атомну масу, яка дорівнювала середньому арифметичному відносних атомних мас двох крайніх елементів тріади. Приклади тріад- Li, Na, K; Ca, Sr, Ba; S, Se, Te. Відкриття нових елементів показало неможливість розмістити їх у тріади.
У 1829 pоці, вивчаючи властивості брому, учений виявив, що цей елемент за своїми властивостями посідає проміжне положення між хлором і йодом. У ряді хлор — бром — йод спостерігалася не лише поступова зміна кольору та реакційної здатності, а й поступова зміна атомної маси. Й. В. Деберейнер продовжив пошуки та знайшов ще дві групи з трьох елементів (він назвав їх тріадами), у яких також спостерігалася поступова зміна властивостей. Цими групами були кальцій, стронцій, барій і сульфур, селен, телур. В обох групах атомна маса середнього елемента приблизно дорівнює середньому арифметичному атомних мас двох інших елементів. Й. В. Деберейнер намагався знайти інші такі тріади, але безуспішно. Оскільки розбити всі відомі на той час елементи на тріади не вдалося, хіміки дійшли висновку, що тріади. Й. В. Деберейнера — явище випадкове. Навіть більше, відповідність у зміні атомних мас і хімічних властивостей елементів у тріадах Й. В. Деберейнера не справило ніякого враження на хіміків. У першій половині XIX ст. хіміки взагалі недооцінювали значення атомних мас.
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}АвторкласифікаціїСутність. Недоліки. Шанкуртуа1862р. Розмістив елементи за порядком збільшення атомних мас по гвинтовій лінії на поверхні циліндра, поділеній 16 рівних частин. При цьому елементи з однаковими властивостями розташувались один під одним. Деякі елементи було розміщено довільно, без урахування їхніх властивостей
Французький геолог Олександр Еміль Бегюйе де Шанкуртуа (1820–1886) також розташував елементи в порядку зростання атомних мас і відзначив їх на так званому «гвинтовому» графіку.І в цьому випадку спостерігалася та сама тенденція: подібні елементи потрапляли у вертикальні стовпці. Публікуючи своє повідомлення, Шанкуртуа не супроводив його побудованим ним графіком, і його робота також залишилася непоміченою.
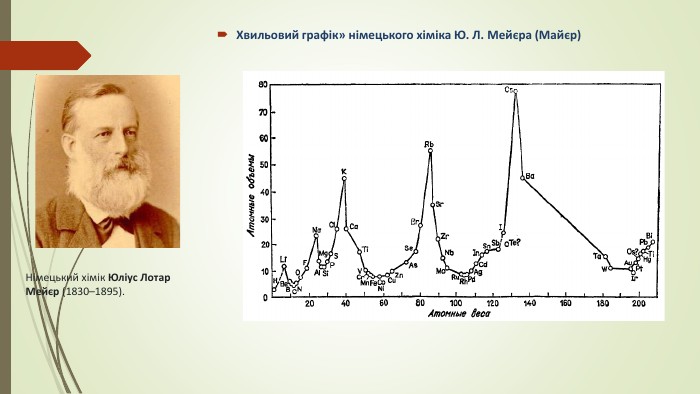
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Автор класифікаціїСутність. Недоліки. Мейер, 1864 р.63 відомих на той час хімічних елементи спробував розмістити за їхньою валентністню в шість груп, але вмістивши лише 28. Помітив певні закономірності в збільшенні атомних мас елементів у групах Не зробив ніяких теоретичних висновків
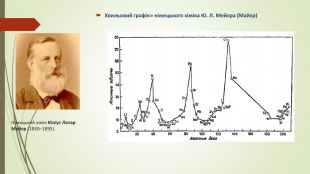
Графічна залежність атомних об’ємів елементів від їхніх атомних мас виражається у вигляді низки хвиль, що підносяться гострими піками в точках, які відповідають лужним металам (натрію, калію, рубідію й цезію). Кожний спуск і підйом до піку відповідає періоду в таблиці елементів. У кожному періоді значення деяких фізичних характеристик, крім атомного об’єму, також закономірно спочатку зменшуються, а потім зростають. Гідроген — елемент із найменшою атомною масою — стояв у списку елементів першим. У той час було прийнято вважати, що перший період включає лише один елемент (у сучасних таблицях перший період включає два елементи — гідроген і гелій.) Другий і третій періоди графіка Ю. Л. Мейєра включали кожен по сім елементів. Ці періоди дублювали октави Дж. Ньюлендса. Однак у наступних двох періодах кількість елементів перевищувала сім. У такий спосіб. Ю. Л. Мейєр показав, у чому помилка Дж. Ньюлендса. Закон октав не міг суворо виконуватися для всього списку елементів, останні періоди мали бути довші за перші.
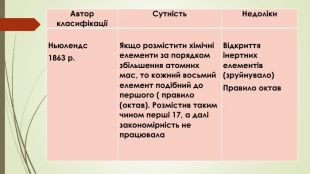
{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Автор класифікаціїСутність. Недоліки. Ньюлендс1863 р. Якщо розмістити хімічні елементи за порядком збільшення атомних мас, то кожний восьмий елемент подібний до першого ( правило (октав). Розмістив таким чином перші 17, а далі закономірність не працювала. Відкриття інертних елементів (зруйнувало)Правило октав
Джон Ньюлендс (1837–1898) розташував відомі елементи в порядку зростання атомних мас. Склавши такий перелік елементів, він виявив, що в отриманому ряді можна виявити певну закономірність у зміні властивостей елементів. Коли Джон Ньюлендс розташував елементи вертикальними стовпчиками по сім елементів у стовпчику, то з’ясувалося, що подібні елементи, як правило, потрапляють у ті самі горизонтальні ряди. Так, калій розташовується слідом за дуже схожим на нього натрієм, селен опиняється в одному ряду зі схожим на нього сульфуром, кальцій — поряд зі схожим на нього магнієм і т. д. Справді, у відповідному ряду можна було знайти кожну з трьох тріад Й. В. Деберейнера. Джон Ньюлендс назвав відкриту ним закономірність законом октав, тому що кожен восьмий елемент мав властивості, подібні до властивостей перших, дев’ятий — другого тощо (у музичній октаві сім нот, восьма нота починає нову октаву.)На жаль, крім рядів, що містять подібні елементи, у таблиці були ряди із зовсім несхожими елементами. Тому решта хіміків вирішила, що такий збіг випадковий, і поставилися до відкриття Джона Ньюлендса як до факту, що не заслуговує на увагу.
Дж. Ньюлендс і Ю. Л. Мейєр близько підійшли до відкриття періодичного закону, помітивши залежність властивостей елементів від їхніх атомних мас, але не зуміли піднятися від спостережуваних ними фактів до сміливих узагальнень. Закон, що об’єднує всі знання про хімічні елементи в струнку природну систему, відкрив російський учений Дмитро Іванович Менделєєв.
Висновок: перші спроби класифікації виявилися невдалими: учені створювали різні за формулою таблиці та графіки, брали за основу подібність складу та властивостей, відкривали певні закономірності, але їм не вдалося створити єдиної системи хімічних елементів, які б виражали взаємозв’язок між усіма елементами.
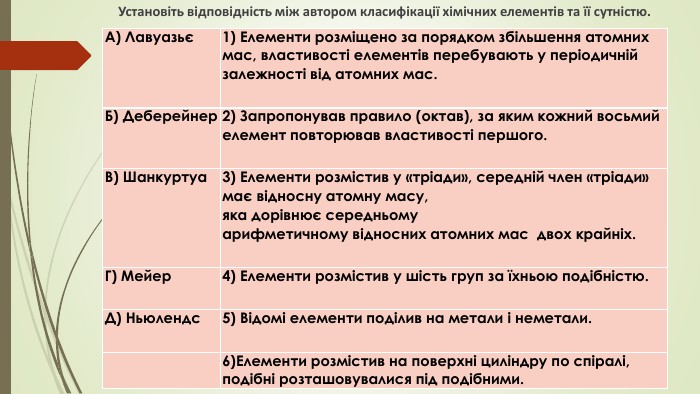
Установіть відповідність між автором класифікації хімічних елементів та її сутністю.{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}А) Лавуазьє 1) Елементи розміщено за порядком збільшення атомних мас, властивості елементів перебувають у періодичній залежності від атомних мас. Б) Деберейнер2) Запропонував правило (октав), за яким кожний восьмий елемент повторював властивості першого. В) Шанкуртуа3) Елементи розмістив у «тріади», середній член «тріади» має відносну атомну масу, яка дорівнює середньому арифметичному відносних атомних мас двох крайніх. Г) Мейер4) Елементи розмістив у шість груп за їхньою подібністю. Д) Ньюлендс5) Відомі елементи поділив на метали і неметали. 6)Елементи розмістив на поверхні циліндру по спіралі, подібні розташовувалися під подібними.


про публікацію авторської розробки
Додати розробку