Презентація на тему: "Полярний та неполярний ковалентний зв'язок"
Про матеріал
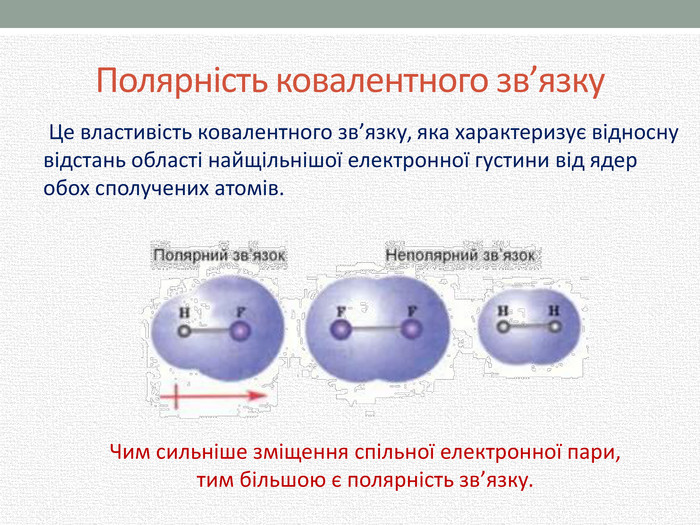
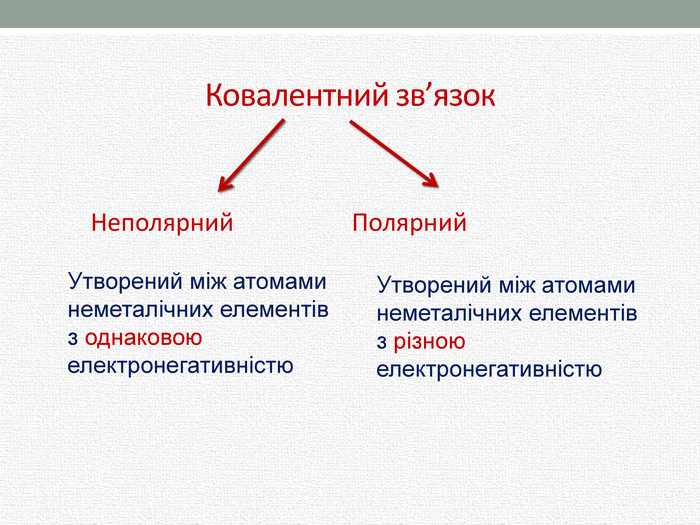
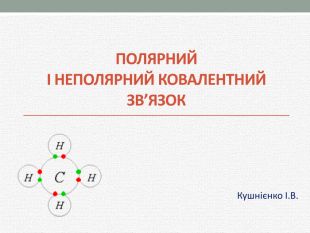
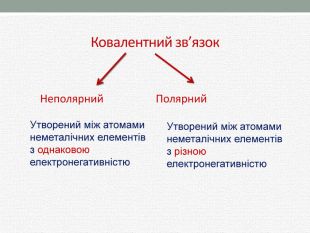
Презентація з хімії для учнів 8 класу на тему "Полярний та неполярний ковалентний зв'язок" розкриває механізм утворення полярного та неполярного ковалентного зв'язку. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку














-

Ціпотан Людмила
14.11.2024 в 20:51
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гнатюк Віра Олексіївна
24.11.2023 в 01:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Полуда Тетяна Олександрівна
31.10.2023 в 19:45
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Коханова Ольга Олексіївна
22.11.2022 в 16:12
Дякую!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук