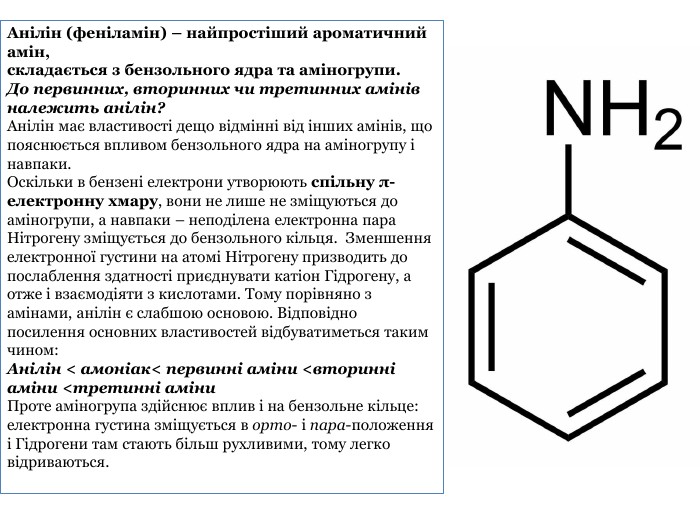
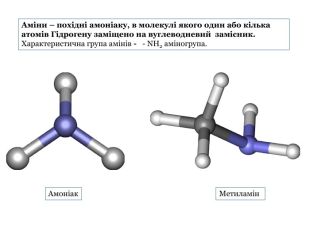
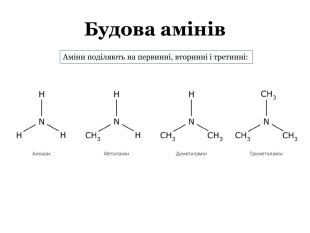
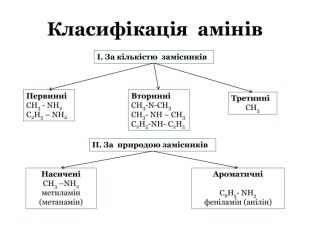
Презентація "Насичені й ароматичні аміни: склад і будова молекул, назви найпростіших за складом сполук. Будова аміногрупи.Аміни як органічні основи. Хімічні властивості."
Про матеріал
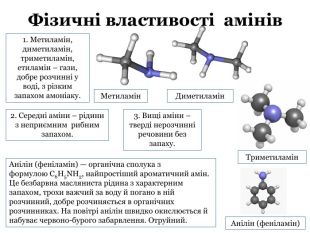
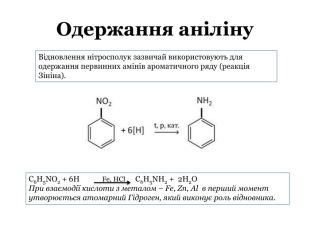
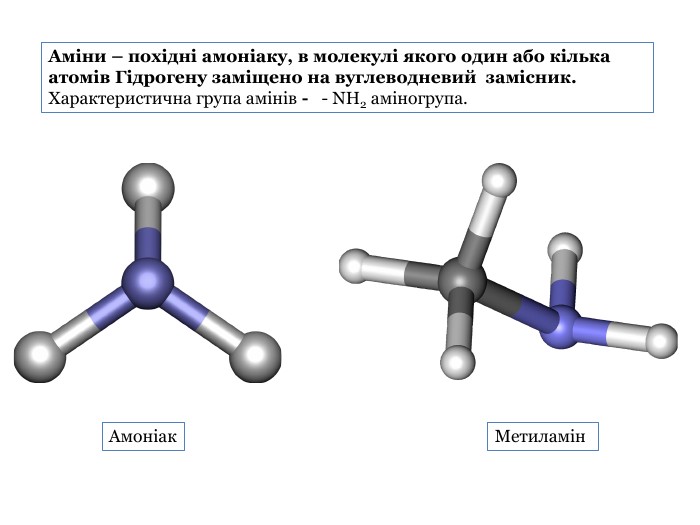
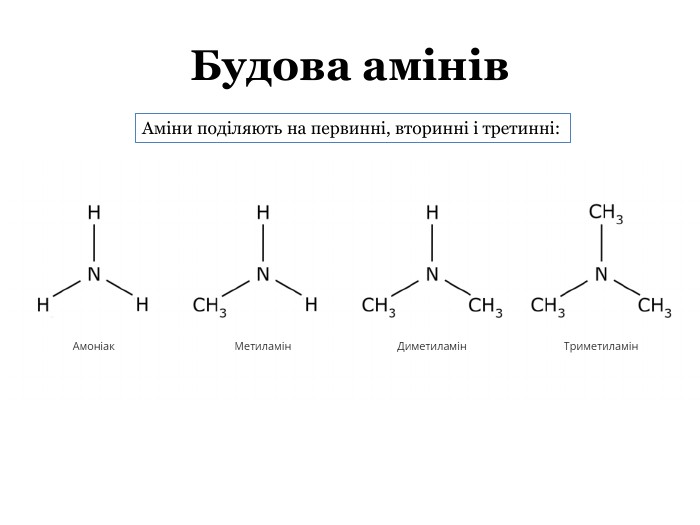
Презентація містить теоретичний матеріал про аміни, їх фізичні та хімічні властивості. Також містить посилання на відеоматеріали з дослідами. Презентація підкріплена формулами та фотоматеріалами. В кінці містяться завдання для узагальнення знань отриманих під час уроку. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку



![2. Взаємодія з кислотами. СН3 NН2 + НCl → [СН3 NН3]Cl. Метиламін метиламоній хлорид1. У пробірку наливаємо 1 мл аніліну.2. До аніліну додаємо приблизно 5 мл води.3. Оскільки анілін обмежено розчинюється у воді, то вони утворюють два окремі шари. 2. Взаємодія з кислотами. СН3 NН2 + НCl → [СН3 NН3]Cl. Метиламін метиламоній хлорид1. У пробірку наливаємо 1 мл аніліну.2. До аніліну додаємо приблизно 5 мл води.3. Оскільки анілін обмежено розчинюється у воді, то вони утворюють два окремі шари.](/uploads/files/507161/339330/391924_images/7.jpg)