Презентація «Неполярний ковалентний зв’язок». 8 клас
Про матеріал
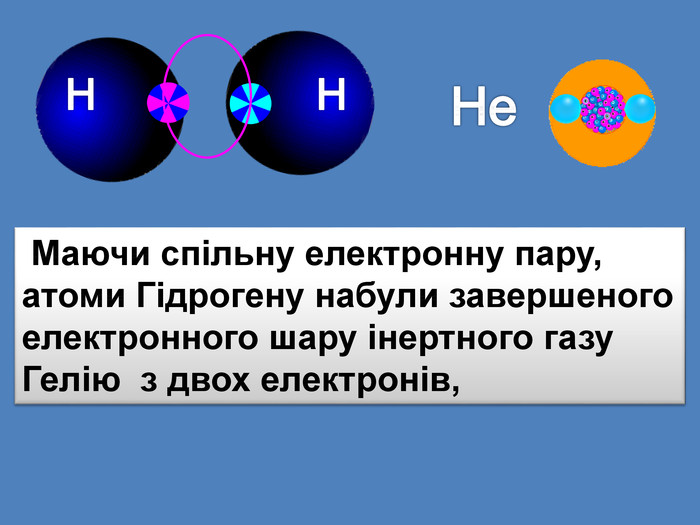
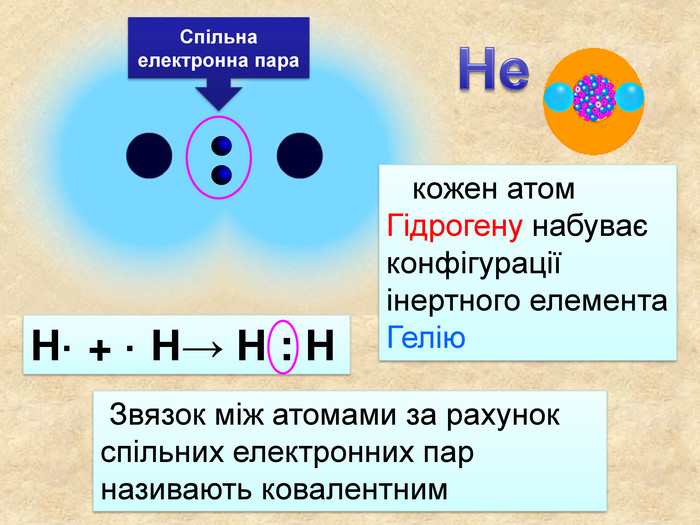
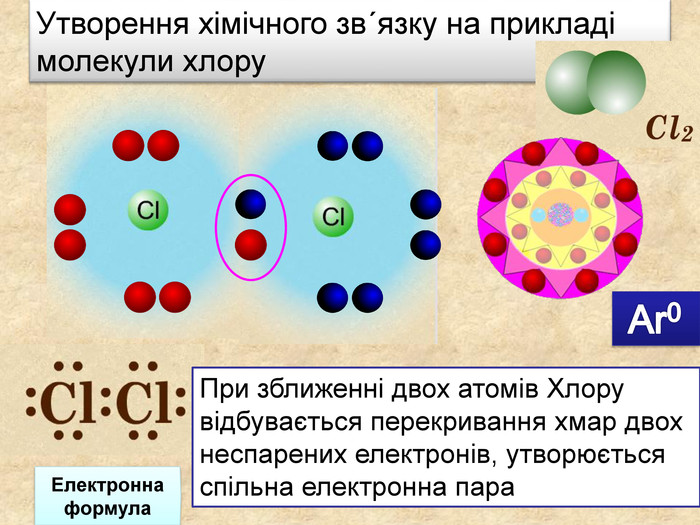
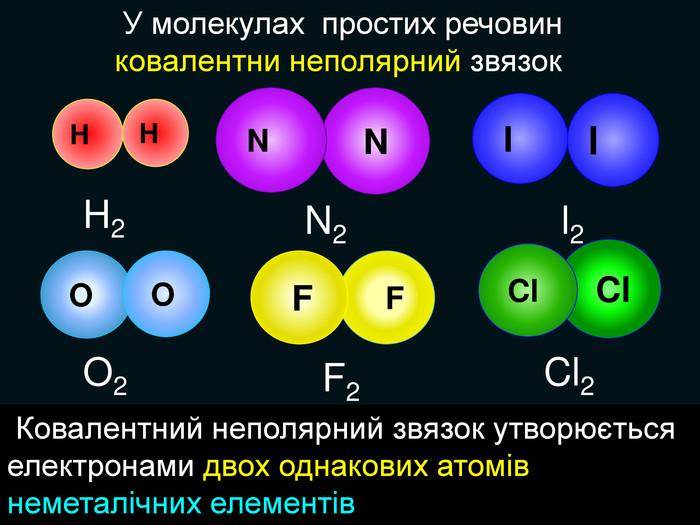
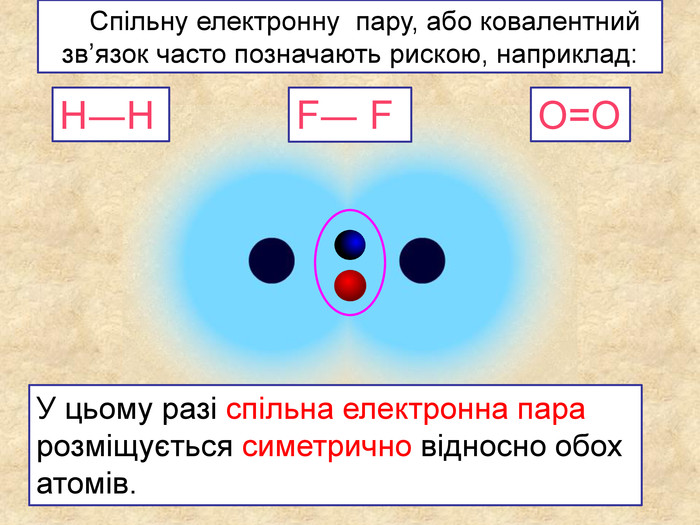
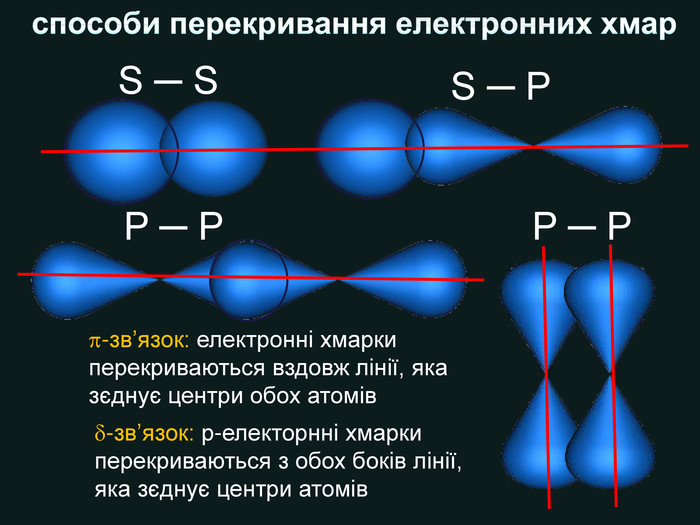
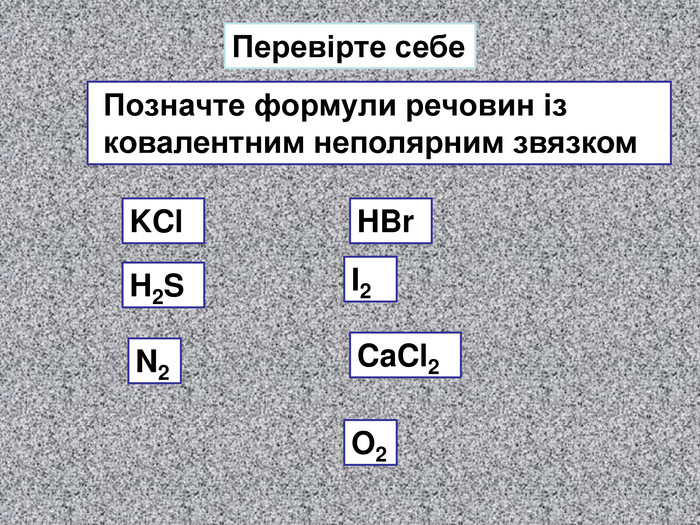
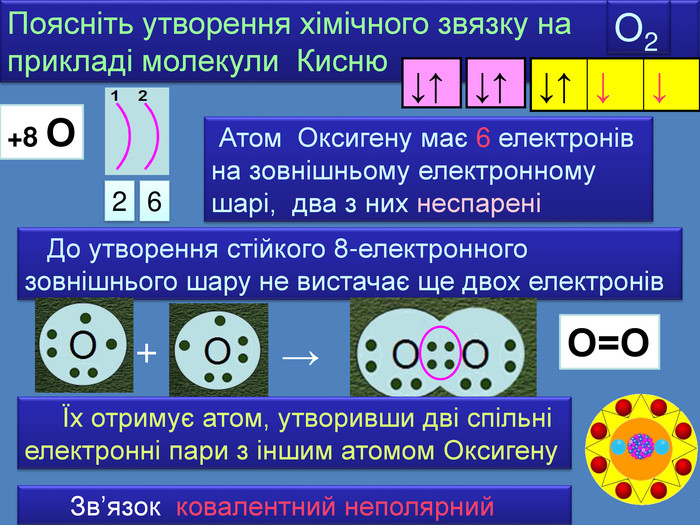
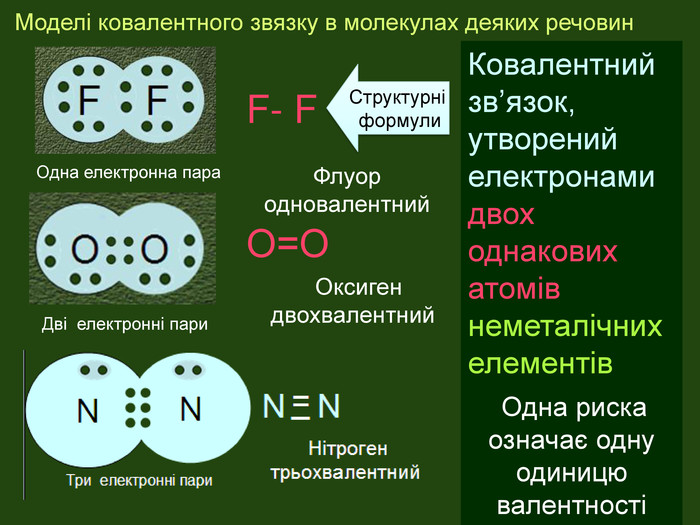
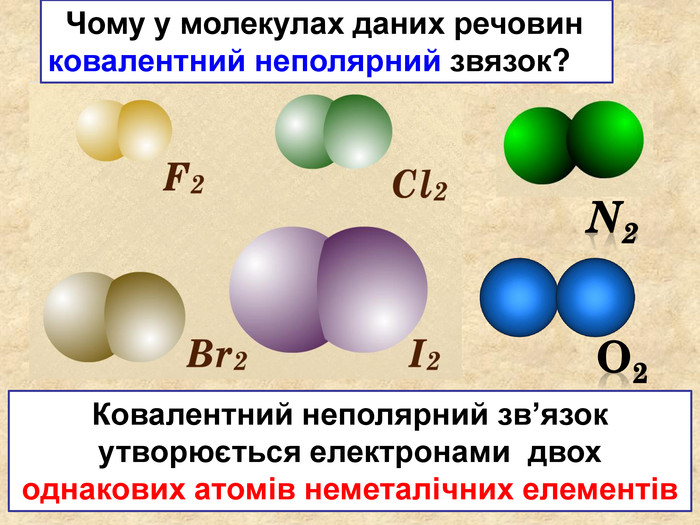
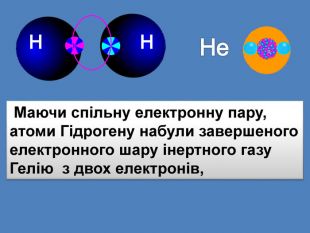
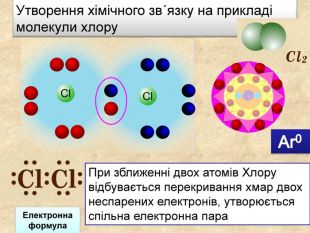
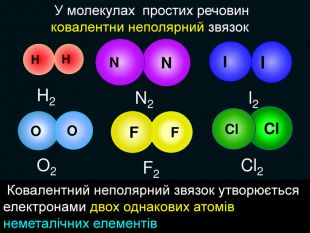
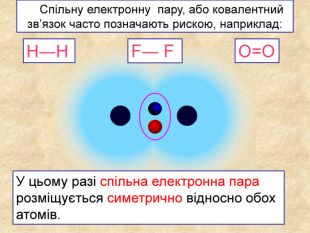
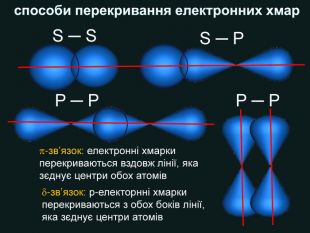
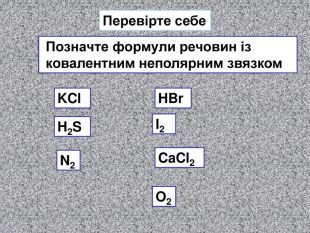
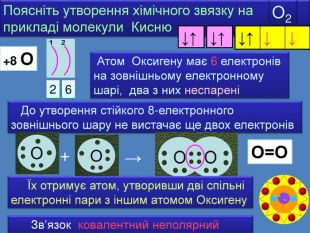
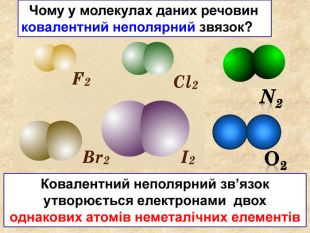
| Презентація допоможе в проведенні уроку на тему: «Неполярний ковалентний зв'язок.» Його утворення. Електронні формули. |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
-
Чудова презентація! Дякую, колего!
-
Дякую, все просто супер
-
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку