Презентація "Оборотні і необоротні реакції"
Про матеріал
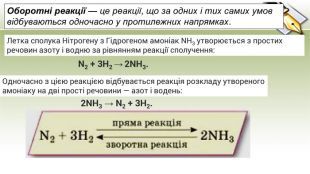
Презентація до уроку на тему "Оборотні і необоротні реакції", 9 клас.Пропонуються тести для перевірки знань та теоретичний матеріал з теми. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку
































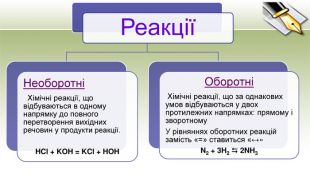


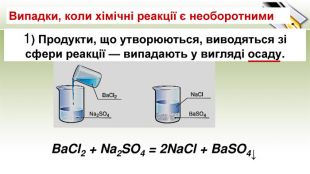
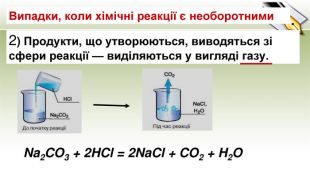
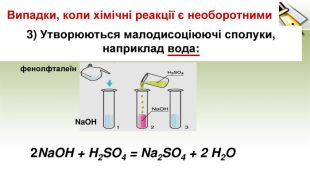






-

Kiriyenko Olena
15.01.2025 в 19:10
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
05.12.2024 в 20:52
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Волошина Олена Іванівна
07.09.2024 в 15:17
Щиро вдячна, дуже гарна празентація
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Палій Людмила Олександрівна
21.01.2023 в 20:58
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Крамар Світлана
25.12.2022 в 22:40
щиро дякую за змістовну презентацію
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 2 відгука