Презентація "Оцтова кислота"
Про матеріал
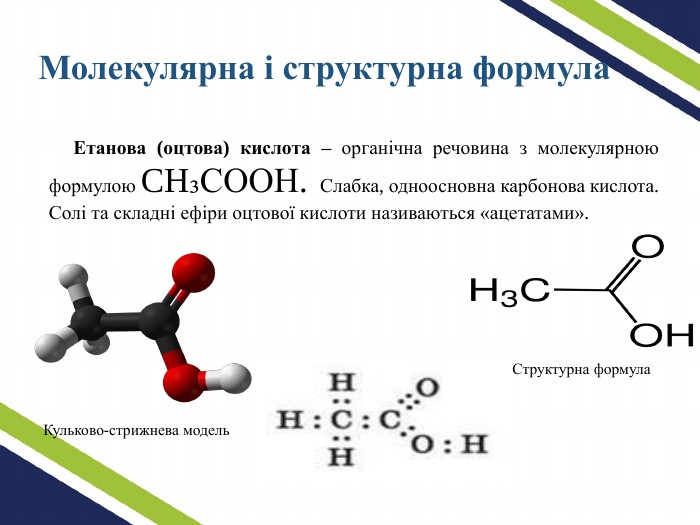
В презентації надано матеріал про оцтову (етанову) кислоту: структурна, молекулярна та електронна формула. Розповідається про виникнення оцтової кислоти. Описуються фізичні та хімічні властивості, особливості добування та застосування кислоти. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку