Презентація «Окисники й відновники» 9 клас
Про матеріал
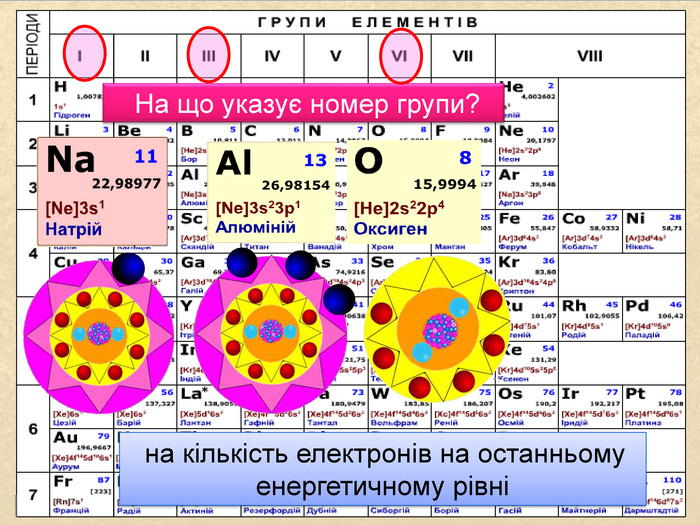
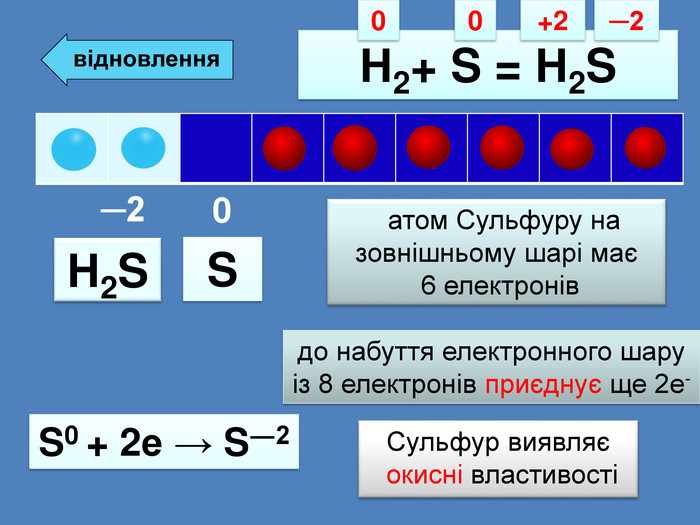
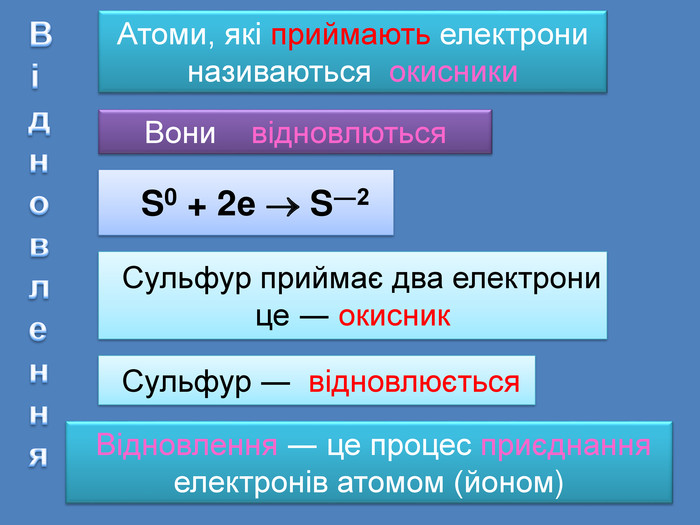
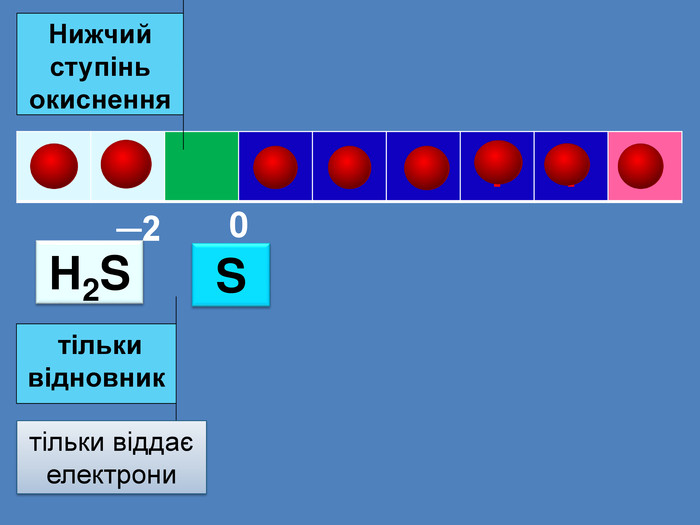
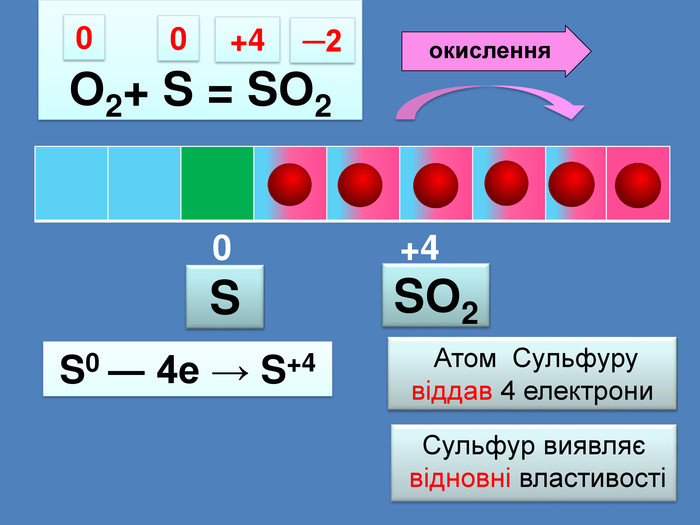
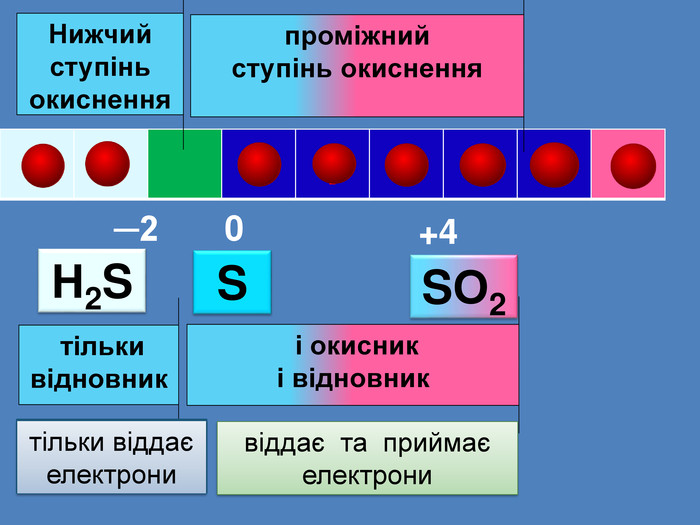
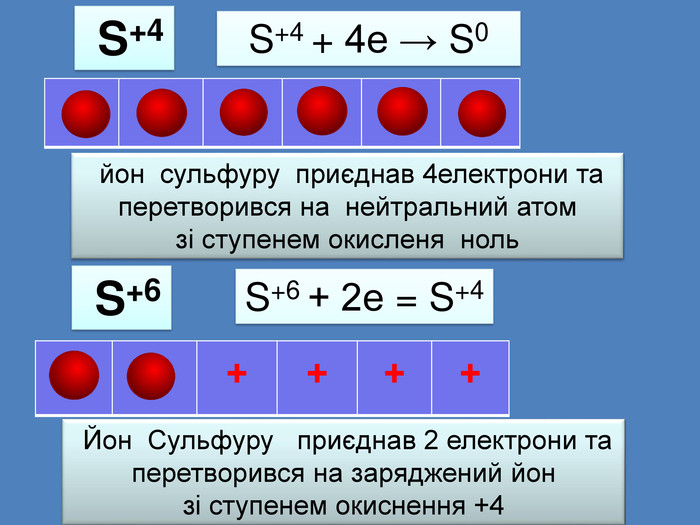
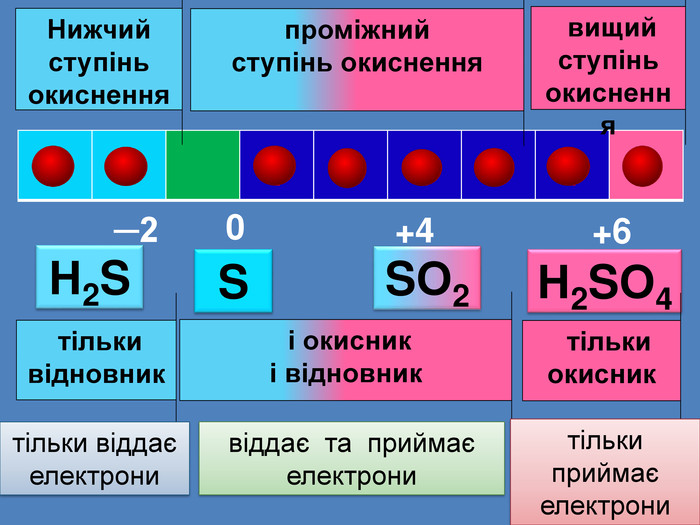
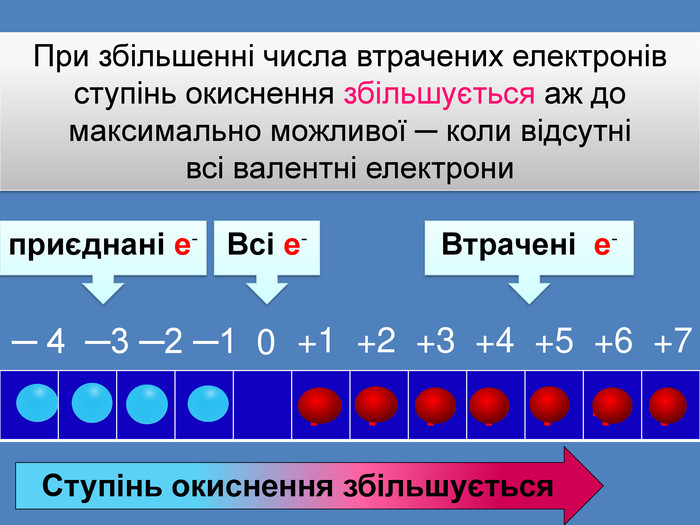
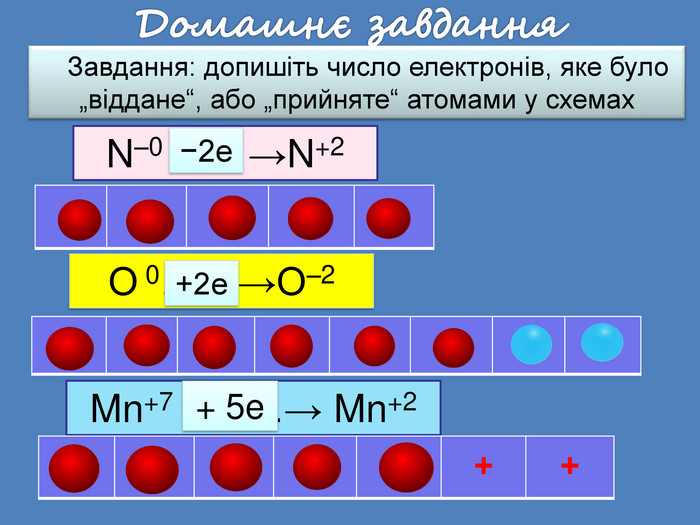
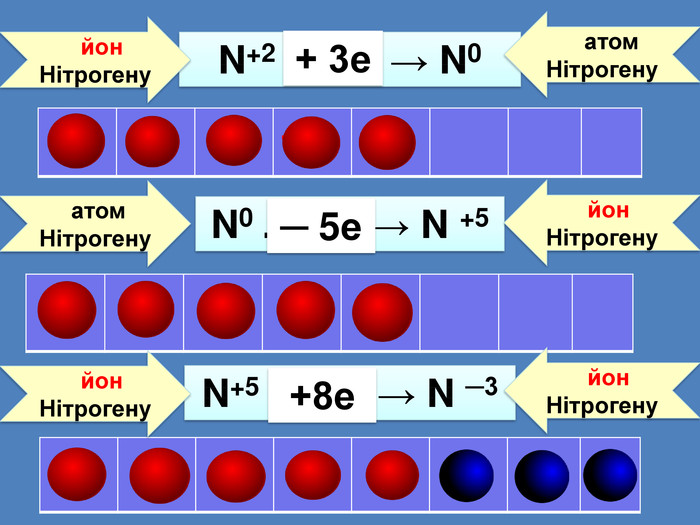
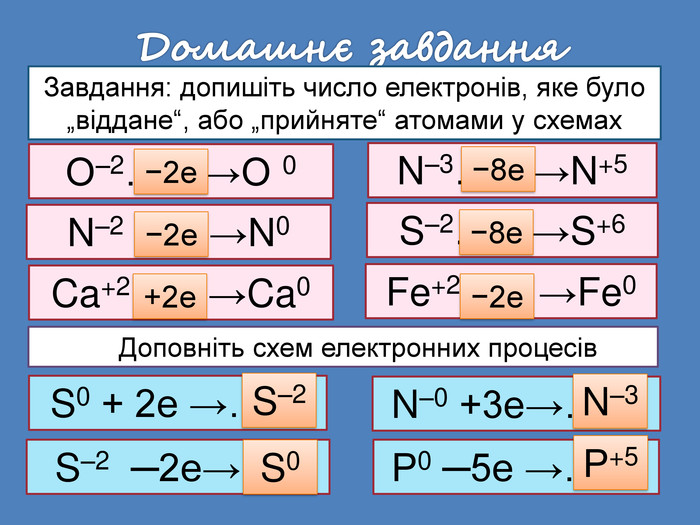
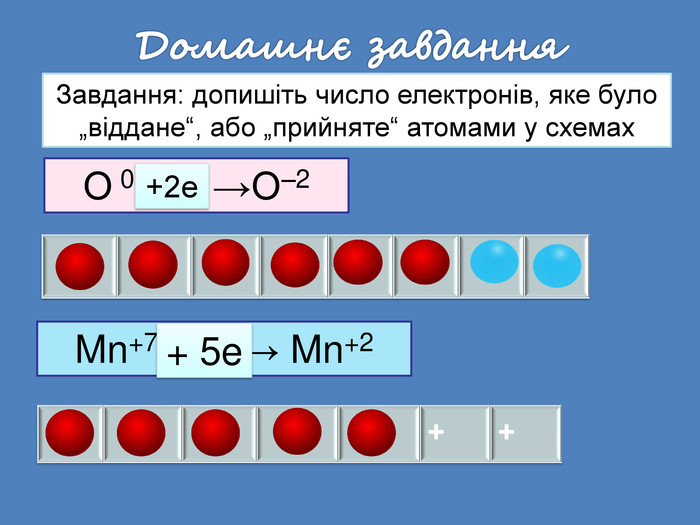
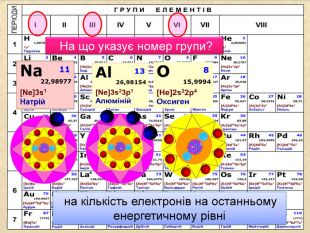
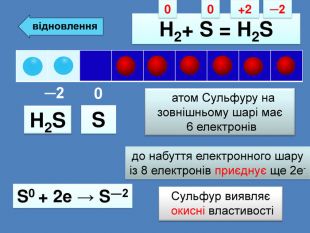
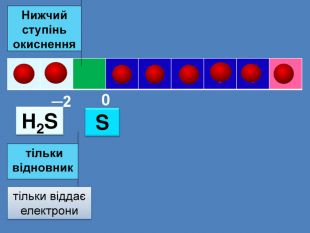
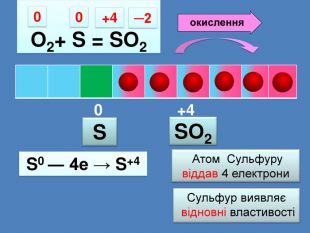
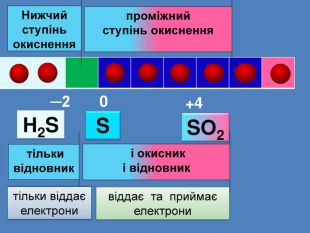
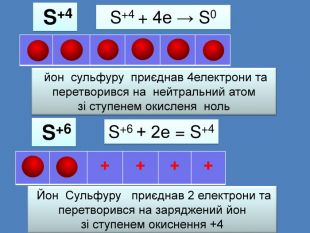
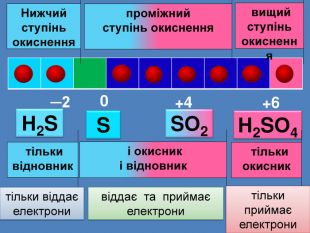
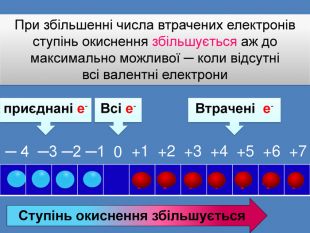
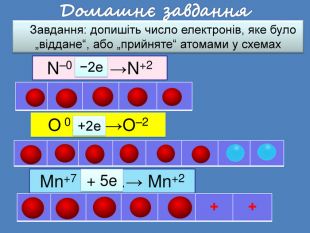
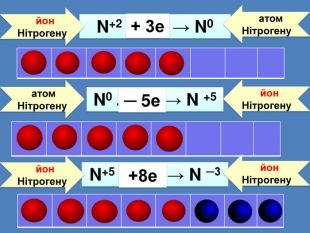
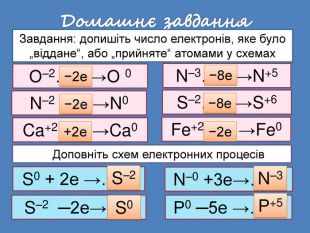
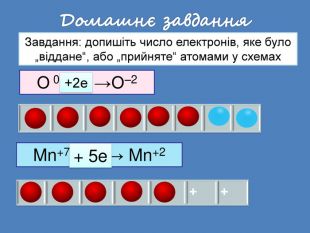
| Презентація допоможе провести урок на тему: «Окисно-відновні реакції. Процеси окиснення, відновлення, окисники, відновники». |
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
До підручника
Хімія 9 клас (Григорович О.В.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку