Презентація:"Оксиди неметалічних елементів, їх уміст в атмосфері".













Бліц-опитування: Сіль 1. Які класи складних неорганічних сполук ви знаєте? ( оксиди, основи, кислоти, солі)2. Складні речовини, що складаються з атомів металу й Оксигену з валентністью ІІ, називають Оксидами.3. За кількістю атомів Гідрогену кислоти поділяються на... Одно, двох ,триосновні)4. Оксиди класифікуються на солетворні та …. (несолетворні)5. Солетворні класифікуються на кислотні,амфотерні й...(Основні)6. Складна речовина, що складається з атомів металу і кислотного залишку,
Бліц-опитування:7. У лужному середовищі фенолфталеїн набуває кольору...(Малинового)8. У результаті взаємодії кислотного й основного оксидів утворюється... (Сіль)9. Розчинні у воді основи називаються..(Лугами)10. Складні речовини утворені атомами гідрогену і кислотними залишками називаються ( кислоти)11. Як називаються речовини з допомогою яких виявляють кислоти, луги ? ( індикатори)
Бліц-опитування:12. Як утворюються назви солей назва металу, римською змінна валентність, назва кислотного залишку)13. У чому полягає відмінність середньої солі від кислої ( наявність атома Гідрогену)14. Що необхідно знати, щоб правильно утворити формулу речовини ( валентність)15. Як утворюються назви оксидів? (назва Ме чи Неме, римської змінна валентність, оксид)16. Які оксиди називають кислотними ?( неметалів).
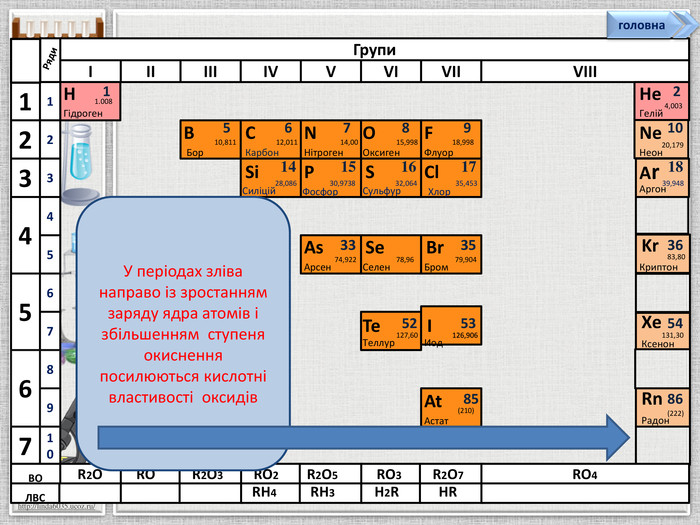
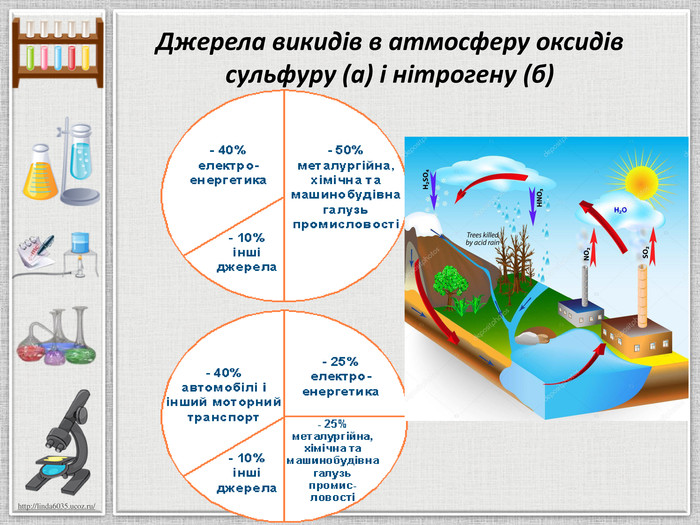
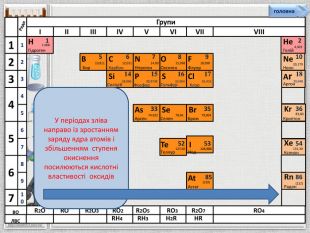
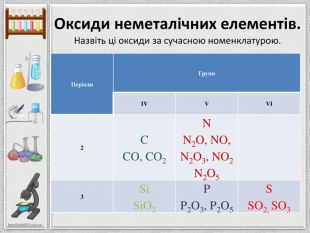
Групи. IIIIIIIVVVIVIIVIIISi1428,086 Силіцій Р1530,9738 Фосфор S1632,064 Сульфур. Cl1735,453 Хлор Ar1839,948 Аргон123475612310456789 Ряди. НГідроген11.008 BCNAs. He. Se. Te. FBr. IAt. Ne. Kr. Xe. Rn. Бор. Карбон. Нітроген. Арсен. Селен. Теллур. Флуор. Бром. Иод. Астат. Криптон. Ксенон. Радон567 OОксиген89210 ЛВС333536525354858610,81112,01114,0074,92215,99878,96127,6018,99879,904126,906(210)4,00320,17983,80131,30(222)Гелій. Неон. RH4 RH3 H2 RHRВОR2 OROR2 O3 RO2 R2 O5 RO3 R2 O7 RO4 У періодах зліва направо із зростанням заряду ядра атомів і збільшенням ступеня окиснення посилюються кислотні властивості оксидівголовна
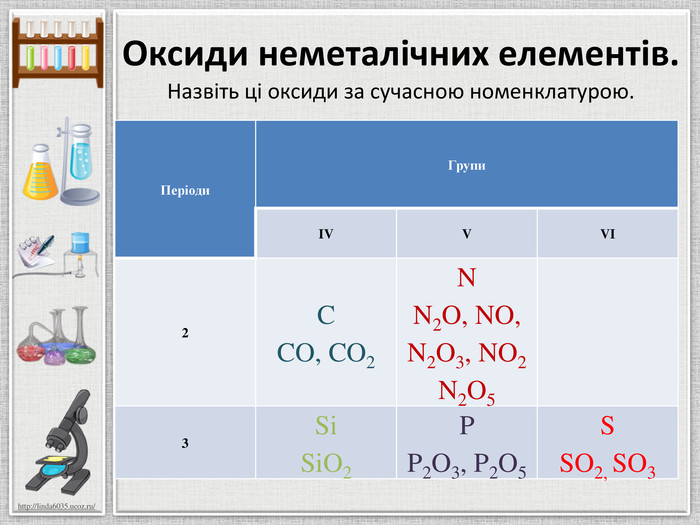
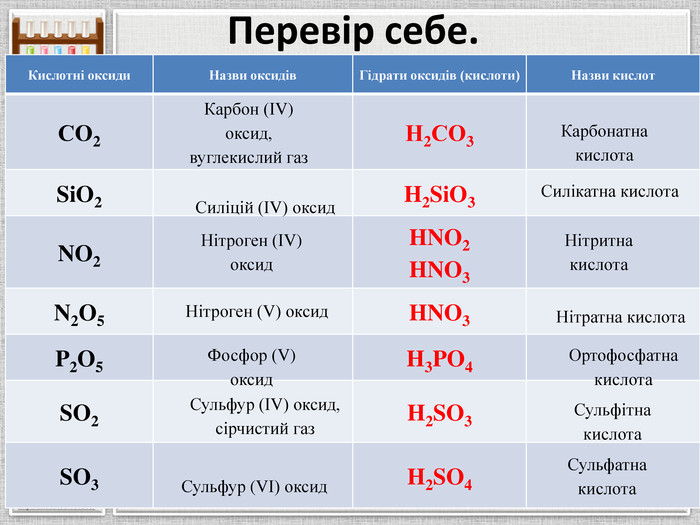
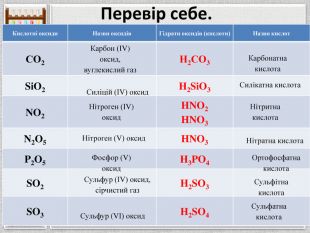
Перевір себе.{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Кислотні оксиди. Назви оксидів. Гідрати оксидів (кислоти)Назви кислот. СО2 Н2 СО3 Si. O2 H2 Si. O3 NO2 HNO2 HNO3 N2 O5 HNO3 P2 O5 H3 PO4 SO2 H2 SO3 SO3 H2 SO4 Карбон (ІV) оксид, вуглекислий газ. Силіцій (ІV) оксид. Нітроген (ІV) оксид. Нітроген (V) оксид. Фосфор (V) оксид. Сульфур (ІV) оксид, сірчистий газ. Сульфур (VІ) оксид. Карбонатна кислота. Силікатна кислота. Нітритна кислота. Нітратна кислота. Ортофосфатна кислота. Сульфітна кислота. Сульфатна кислота
Складіть порівняльну характеристику кислотних оксидів , дані запишіть у таблицю.{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}Ознаки для порівняння. СОСО2 SO2 SO3 NO NO2 Назва оксидів. Формула оксидів. Фізичні властивостіХарактер оксидів. Хімічні властивостіФормула гідрату оксиду. Фізіологічна дія. Вплив на довкілля. Застосування
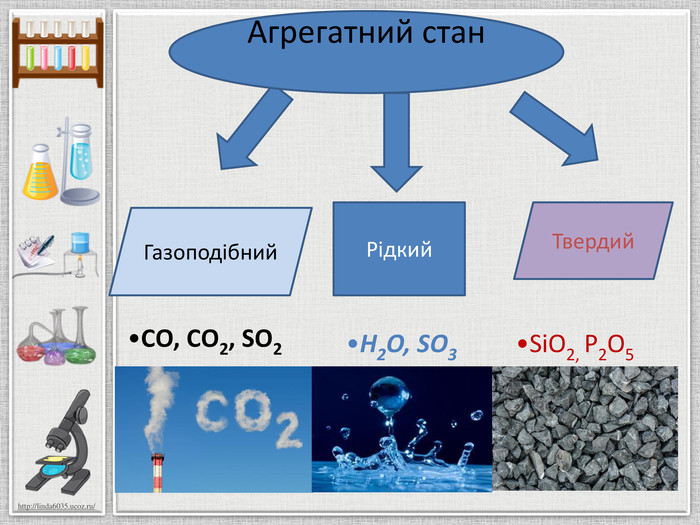
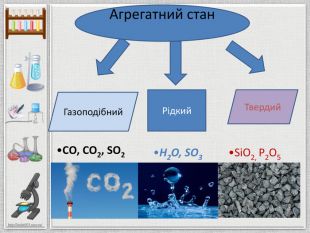
Картка №1{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}SO2 Сульфур (ІY) оксид, сульфур діоксид, сірчистий газ. Фізичні властивостіБезбарвний газ із різким задушливим запахом, легко розчиняється у воді. Під час охолодження до -10о. С зріджується у безбарвну рідину, а при -73о. С кристалізується. Хімічні властивостіПри взаємодії з лугами утворюється сіль та вода. Фізіологічна дія. Токсичний. Невелика концентрація його у повітрі викликає подразнення слизових оболонок дихальних шляхів і очей. Тривала дія навіть малих концентрацій призводить до виникнення бронхіту, гастриту та ін., викликає загальне ослаблення організму. Знебарвлює багато органічних барвників . Вплив на навколишнє середовище. Один із основних забруднювачів повітря. Потрапляючи у повітря в результаті спалювання палива, утворення димових газів під час виплавляння металів, роботи автомобільного транспорту (вихлопні гази). Добування1. Горіння сірки: S + O2 = SO2.2. Взаємодією сульфітів з кислотами. Meх(SO3)у + Hх. R → Meх. Rу + SO2 + H2 O.3. Розклад сульфітної кислоти. H2 SO3 → H2 O + SO2.4. При взаємодії малоактивних металів з концентрованою сульфатною кислотою. Застосування. Добування H2 SO4, білення соломи, вовни, шовку. Обкурювання овочесховищ (вбиває плісняві гриби), плодів і фруктів, щоб запобігти загниванню.
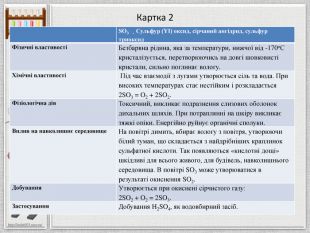
Картка 2{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}SO3 - Сульфур (YІ) оксид, сірчаний ангідрид, сульфур триоксид. Фізичні властивостіБезбарвна рідина, яка за температури, нижчої від -170о. С кристалізується, перетворюючись на довгі шовковисті кристали, сильно поглинає вологу. Хімічні властивості Під час взаємодії з лугами утворюється сіль та вода. При високих температурах стає нестійким і розкладається2 SO3 = O2 + 2 SO2. Фізіологічна дія. Токсичний, викликає подразнення слизових оболонок дихальних шляхів. При потраплянні на шкіру викликає тяжкі опіки. Енергійно руйнує органічні сполуки. Вплив на навколишнє середовище. На повітрі димить, вбирає вологу з повітря, утворюючи білий туман, що складається з найдрібніших краплинок сульфатної кислоти. Так появляються «кислотні дощі» шкідливі для всього живого, для будівель, навколишнього середовища. В повітрі SO3 може утворюватися в результаті окиснення SO2. Добування. Утворюється при окиснені сірчистого газу:2 SO2 + O2 = 2 SO3. Застосування. Добування H2 SO4, як водовбирний засіб.
Картка № 3{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}NO нітроген(II) оксид,монооксид. Фізичні властивостіБезбарвний газ, погано розчинний у воді, без запаху, несолетворний. При низькій температурі зріджується і кипить при-151,80 С, а при -163,70 С переходить у твердий стан. Поширення у природіУтворюється в повітрі при взаємодії азоту з киснем під час грозових розрядів: N2 + O2 = 2 NO. На повітрі легко окиснюється, перетворюючись на бурий газ NO2:2 NО + O2 = 2 NO2. Взаємодія з водою. З водою не взаємодіє. Малоактивний. Взаємодія з лугами. Не взаємодіє. Взаємодія з іншими речовинами2 NО + SO2 → N2 O + SO32 NО + 2 Mg → 2 Mg. O + N22 NО + O2 → 2 NO22 NО + Cl2 → 2 NOCl. Добування в лабораторії і промисловостіПри взаємодії міді з розбавленою нітратною кислотою, окисненням амоніаку, азоту:3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2 O;4 NH3 + 5 O2 → 4 NO + 6 H2 ON2 + O2 → 2 NO
Картка 4{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}NO2 нітроген(IV) оксид, діоксин нітрогену. Фізичні властивостіБурий газ з різким характерним запахом, отруйний, подразнює дихальні шляхи, добре розчинний у воді. Солетворний, проявляє властивості кислотних оксидів. Поширення у природіУ вигляді «лисячого хвоста» викидається в атмосферу заводами, що виробляють нітратну кислоту, і є шкідливим для всього живого. Взаємодія з водою. Взаємодіє з водою з утворенням кислот.а) за надлишку кисню утворюється тільки нітратна кислота:4 NО2 + O2 + H2 O = 4 НNO3;б) при розчиненні у теплій воді утворюється нітратна кислота і NО:3 NО2 + H2 O = 2 НNO3 + NО;в) добре розчиняється у воді утворюючи суміш двох кислот:2 NО2 + H2 O = НNO3 + НNО2. Взаємодія з лугами. З розчином лугу утворює солі обох кислот:2 NО2 + 2 Na. OH = Na. NO3 + Na. NО2 + H2 O. Взаємодія з іншими речовинами10 NО2 + 8 P → 4 P2 O5 + 5 N22 NО2 + 7 H2 → 4 H2 O + 2 NH3 Добування в лабораторії і промисловостіПри взаємодії міді з концентрованою нітратною кислотою, розкладанням деяких нітратів: Cu + 4 HNO3 = Cu(NO3)2 + 2 NO2 + 2 H2 O2 Pв(NO3)2 → 2 Pb. O + 4 NO2 + O2
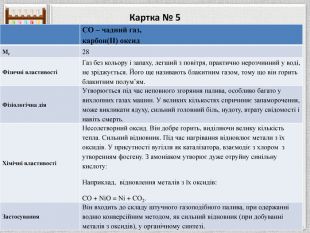
Картка № 5{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}СО – чадний газ,карбон(II) оксид. Mr28 Фізичні властивостіГаз без кольору і запаху, легший з повітря, практично нерозчинний у воді, не зріджується. Його ще називають блакитним газом, тому що він горить блакитним полум’ям. Фізіологічна дія. Утворюється під час неповного згоряння палива, особливо багато у вихлопних газах машин. У великих кількостях спричиняє запаморочення, може викликати ядуху, сильний головний біль, нудоту, втрату свідомості і навіть смерть. Хімічні властивостіНесолетворний оксид. Він добре горить, виділяючи велику кількість тепла. Сильний відновник. Під час нагрівання відновлює метали з їх оксидів. У присутності вугілля як каталізатора, взаємодіє з хлором з утворенням фосгену. З амоніаком утворює дуже отруйну синільну кислоту: Наприклад, відновлення металів з їх оксидів: CO + Ni. O = Ni + CO2. Застосування. Він входить до складу штучного газоподібного палива, при одержанні водню конверсійним методом, як сильний відновник (при добуванні металів з оксидів), у органічному синтезі.
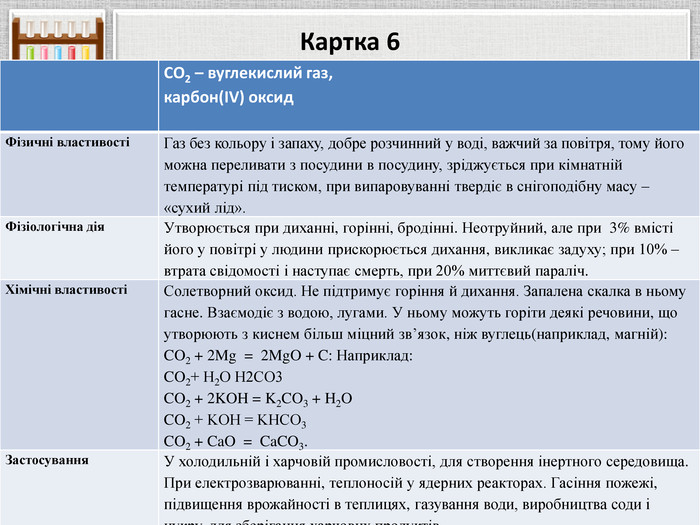
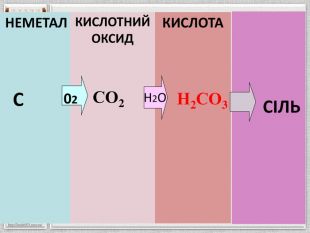
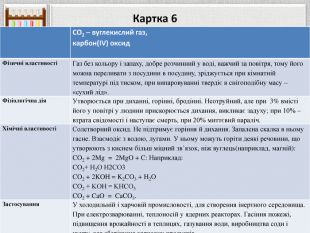
Картка 6{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}СО2 – вуглекислий газ,карбон(IV) оксид. Фізичні властивостіГаз без кольору і запаху, добре розчинний у воді, важчий за повітря, тому його можна переливати з посудини в посудину, зріджується при кімнатній температурі під тиском, при випаровуванні твердіє в снігоподібну масу – «сухий лід». Фізіологічна дія. Утворюється при диханні, горінні, бродінні. Неотруйний, але при 3% вмісті його у повітрі у людини прискорюється дихання, викликає задуху; при 10% – втрата свідомості і наступає смерть, при 20% миттєвий параліч. Хімічні властивостіСолетворний оксид. Не підтримує горіння й дихання. Запалена скалка в ньому гасне. Взаємодіє з водою, лугами. У ньому можуть горіти деякі речовини, що утворюють з киснем більш міцний зв’язок, ніж вуглець(наприклад, магній): CO2 + 2 Mg = 2 Mg. O + C: Наприклад: CO2+ Н2 О Н2 CO3 CO2 + 2 KOH = K2 CO3 + H2 OCO2 + KOH = KНCO3 CO2 + Ca. O = Ca. CO3. Застосування. У холодильній і харчовій промисловості, для створення інертного середовища. При електрозварюванні, теплоносій у ядерних реакторах. Гасіння пожежі, підвищення врожайності в теплицях, газування води, виробництва соди і цукру, для зберігання харчових продуктів.
Вы можете использовать данное оформление для создания своих презентаций, но в своей презентации вы должны указать источник шаблона: Фокина Лидия Петровнаучитель начальных классов. МКОУ «СОШ ст. Евсино»Искитимского района. Новосибирской области. Сайт http://pedsovet.su/ СПАСИБО АВТОРАМ ФОНОВ И КАРТИНОК
Интернет-ресурсы: Микроскоп http://img-fotki.yandex.ru/get/9299/134091466.f5/0_d4d6e_ccd0a668_S Колбы http://img-fotki.yandex.ru/get/6613/134091466.a/0_8eae3_6ea58e84_S Пробирки http://img-fotki.yandex.ru/get/9300/134091466.c5/0_c98b9_19d24419_S Горелка http://img-fotki.yandex.ru/get/4904/134091466.f5/0_d4d6d_4740c1eb_S Колбы http://img-fotki.yandex.ru/get/9558/134091466.9a/0_c0378_bebb161_S Блокнот с ручкой http://img-fotki.yandex.ru/get/19/108950446.6d/0_b4102_1793a431_S


про публікацію авторської розробки
Додати розробку










-

Кичук Світлана
06.05.2024 в 09:49
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Висоцька Ольга
03.03.2023 в 23:26
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзева Інна Євгенівна
11.01.2023 в 22:56
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Кільчевська Інна Сергіївна
21.09.2022 в 21:19
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

горбенко катерина
27.01.2022 в 10:13
Вдячна за розробку
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Наконечна Людмила Ігорівна
16.01.2022 в 19:39
Загальна:
4.3
Структурованість
4.0
Оригінальність викладу
4.0
Відповідність темі
5.0
-

Крупа Наталія Іванівна
24.01.2021 в 13:14
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Степаненко Тетяна Іванівна
21.01.2021 в 14:21
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Kyriienko Svitlana
17.01.2021 в 20:53
Вдячність за якість
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 6 відгуків